Questões
- Caracterizar a morfologia do tecido ósseo e seu processo de mineralização. Como os vasos sanguíneos são organizados nos ossos?
- Descreva o processo de envelhecimento no tecido ósseo.
- Definir e diferenciar osteopenia e osteoporose. Caracterizar a fisiopatologia da osteoporose.
- Caracterizar a morfologia e a função do tecido cartilaginoso.
- Descrever o processo de envelhecimento do tecido cartilaginoso.
- Diferenciar artrite e artrose. Caracterizar a fisiopatologia da osteoartrite.
- Descrever a cascata do ácido araquidônico. Onde os anti-inflamatórios irão atuar? Falar do uso crônico dos anti-inflamatórios. Identificar medidas não farmacológicas no tratamento da osteoartrite.
- Conceituar avaliação de risco cirúrgico (ASA – Avaliação de Risco Cirúrgico Anestesiologia). Relacionar risco e cirurgia, dependendo de sua gravidade.
- Caracterizar o estatuto do idoso e citar políticas públicas de apoio. Identificar dados epidemiológicos sobre fraturas por quedas em idosos.
Respostas
-
Caracterizar a morfologia do tecido ósseo e seu processo de mineralização. Como os vasos sanguíneos são organizados nos ossos?
Osso
O tecido ósseo é um sistema orgânico em constante remodelação, fruto dos processos de formação (pelos osteoblastos) e reabsorção (pelos osteoclastos). Nas duas primeiras décadas de vida, predomina a formação e há um incremento progressivo da massa óssea; após a soldadura das epífises, persiste ainda um predomínio construtivo, se bem que em menor ritmo, e o ser humano alcança sua maior massa óssea na quarta década da vida: é o chamado “pico de massa óssea”. A partir daí, praticamente, estabiliza-se a taxa de formação, enquanto a de reabsorção aumenta. Por conseguinte, passa a ocorrer perda progressiva, absoluta, da massa óssea até então presente: é a “osteopenia fisiológica”. Muitos consideram que tal pico ocorre aproximadamente aos 25 anos, uma vez que daí até os 35 anos o incremento é muito pequeno. De toda forma, admite-se que 90% da massa óssea seja alcançada próximo aos 18 anos de idade.
- Tecido ósseo
O tecido ósseo é um tipo de tecido conjuntivo que apresenta características de dureza e alta resistência. Este tecido é constituído por células e fibras imersas numa substância dura e inflexível, ou seja, uma matriz extracelular calcificada, que apresenta 50% de parte orgânica e 50% de material mineral, bem adequada para as funções de sustentação e de proteção que desempenha.
As principais funções deste tecido, principal componente dos ossos do corpo, são realizar o suporte das partes moles, além da proteção dos órgãos vitais; – como os órgãos contidos nas caixas: craniana e torácica, bem como no canal raquidiano – disponibilizar um ponto de inserção para os músculos esqueléticos e tendões, fator necessário para a movimentação do corpo, além de constituir um sistema de alavancas, que amplia a força gerada a partir da contração muscular; e o tecido ósseo ainda atua como depósito de cálcio, fosfato e outros íons, que são indispensáveis para diversas funções do metabolismo celular.
A difusão de substâncias através do tecido ósseo depende da presença de canalículos presentes na matriz óssea, caso contrário, não seria possível a nutrição das células ósseas. Tais canalículos possibilitam que ocorra a troca de íons entre os capilares que irrigam o tecido e as células.
O tecido ósseo apresenta algumas características morfológicas e funcionais que o diferenciam do tecido cartilaginoso, a saber:
– O tecido ósseo possui um sistema peculiar de canalículos, já o cartilaginoso não o apresenta;
-Por último, mas não menos importante, o tecido ósseo possui um suprimento vascular direto e o tecido cartilaginoso é avascular.
O tecido ósseo é formado por três tipos celulares básicos: os osteoblastos, os osteoclastos e os osteócitos.
Os osteoblastos estão relacionados com a deposição do osso. Essas células atuam secretando as substâncias que formarão a matriz extracelular. Elas apresentam prolongamentos citoplasmáticos que se conectam com outros osteoblastos.
Os osteócitos são os osteoblastos maduros, após serem circundados pela matriz óssea que produziram. Essas células de formato estrelado ficam dentro de cavidades.
Os osteoclastos, células grandes com vários núcleos, são as células originadas a partir dos monócitos, que atuam reabsorvendo o osso. Essas células são relacionadas com a remodelagem.
O tecido ósseo é vascularizado e inervado. Ao observarmos um corte transversal de um tecido ósseo, vamos verificar a presença de camadas de matriz extracelular distribuídas de forma concêntrica em torno de um canal central. Nesse canal central, também chamado de canal de Havers, é por onde nervos e vasos sanguíneos passam. Essa estrutura formada pela matriz concêntrica juntamente ao canal de Havers é chamada de osteônios ou sistema de Havers.
O tecido ósseo pode ser classificado em dois tipos: o ósseo compacto e o ósseo poroso ou esponjoso. O tecido ósseo compacto é mais resistente que o tecido ósseo poroso.
Os ossos são envolvidos por uma membrana de tecido conjuntivo chamada de periósteo. Sua função principal é atuar na regeneração do osso, uma vez que é um tecido vascularizado. Esse tecido também ajuda na nutrição do tecido ósseo.
No interior do osso, encontramos uma substância de natureza conjuntiva denominada medula óssea. A medula pode ser de dois tipos: amarela (formada por tecido adiposo) e vermelha (relacionada com a formação de células sanguíneas).
- Matriz extracelular
A matriz extracelular é composta por colágeno em sua maior parte. O colágeno é encontrado em todos os tecidos do corpo, sendo uma proteína fibrosa sintetizada por fibroblastos e células relacionadas, tais como os condroblastos da cartilagem e os osteoblastos do osso.
O osso é constituído aproximadamente por 70% de minerais, 20% de matriz orgânica e cerca de 10% de água, o que o diferencia de outros tecidos conjuntivos menos rígidos. A matriz mineral ou inorgânica é formada predominantemente por Ca e P, na forma de cristais de hidroxiapatita, Ca3(PO4)2, constituindo aproximadamente 60 a 70% do peso do osso e sendo responsável pelas propriedades de rigidez e resistência à compressão. Outros minerais também são encontrados, como 13% de carbonato de Ca (CaCO3), e 2% de fosfato de magnésio, Mg (PO4)2.
- Osteoblastos
São células diferenciadas que produzem a matriz óssea, secretando colágeno e a substância fundamental, que constituem o osteóide e situam-se em aposição ao osso em formação. Essas células também participam da calcificação da matriz. Além disso, durante o crescimento ósseo e talvez durante a remodelagem do osso adulto, os osteoblastos secretam vesículas ricas em Ca para o osteóide em calcificação.
- Osteoclastos
São responsáveis pela reabsorção óssea. São células grandes que surgem pela fusão de células mononucleadas e podem ter até 50 núcleos. A parte do osteoclasto que entra em contato com o osso se apresenta altamente pregueada e é chamada de borda estriada. Esta varre a superfície do osso, continuamente alterando sua configuração, à medida que libera ácidos e enzimas hidrolíticas que dissolvem a matriz proteica e os cristais de minerais. Quando a reabsorção é completada, os osteoclastos são inativados e perdem alguns de seus núcleos.
- Mineralização óssea
O estágio inicial na produção óssea consiste na secreção de moléculas de colágeno (monômeros de colágeno) e da substância fundamental por osteoblastos. Os monômeros de colágeno sofrem rápida polimerização, formando fibras colágenas; o tecido resultante, por sua vez, transforma-se em osteóide, um material parecido com a cartilagem, mas distinto devido à fácil precipitação dos sais de cálcio sobre ele.
A medida que o osteóide é formado, certa quantidade dos osteoblastos vem a ser encarcerada no osteóide e torna-se quiescente. Nesse estágio, essas células recebem o nome dos osteócitos.
Dentre de alguns dias após a formação do osteóide, os sais de cálcio começam a precipitar sobre as superfícies das fibras colágenas. Os precipitados aparecem primeiramente espaçados ao longe de cada fibra colágena, constituindo ninhos minúsculos, que se multiplicam e se desenvolvem rapidamente no período de alguns dias a semanas, até formar o produto final, os cristais de hidroxiapatita.
Os sais iniciais de cálcio a ser depositados não são cristais de hidroxiapatita, mas sim compostos amorfos – não cristalinos; uma mistura de sais. Então, por meio de um processo de substituição e adição de átomos, ou reabsorção e nova precipitação, esses sais convertem-se em cristais de hidroxipatita em semanas ou meses. Certa porcentagem pode permanecer permanentemente na forma amorfa. Esses sais amorfos podem ser absorvidos com rapidez quando houver necessidade de cálcio extra no liquido extracelular.
O mecanismo indutor da deposição dos sais de cálcio no osteóide não é totalmente compreendido. Uma teoria apoia que, no momento da formação, as fibras colágenas são pré-formadas para provocar a precipitação dos sais de cálcio.
Os osteoblastos supostamente também secretam uma substancia no osteóide para neutralizar um inibidor (principalmente o pirofosfato), que costuma evitar a cristalização hidroxiapatita. Uma vez que o pirofosfato tenha sido neutralizado, a afinidade natural das fibras colágenas com os sais de cálcio provoca a precipitação.
Embora os sais de cálcio quase nunca precipitem em tecidos normais além do osso, sua precipitação é possível sob condições anormais. Por exemplo, tal precipitação ocorre nas paredes arteriais na condição denominada arteriosclerose, levando as artérias a se transformar em tubos semelhantes a ossos.
- Deposição óssea pelos osteoblastos
O osso sofre contínua deposição de osteoblastos e ininterrupta absorção nos locais onde os osteoclastos se encontrem ativos. Os osteoblastos são encontrados nas superfícies externas dos ossos e nas cavidades ósseas.
- Absorção óssea – função dos osteoclastos
O osso também sofre uma continua absorção na presença de osteoclastos que correspondem a grandes células fagocitárias multinucleadas, derivadas de monócitos ou células semelhantes formadas na medula óssea.
A absorção óssea ocorre nas adjacências imediatas aos osteoclastos. Acredita-se que o mecanismo dessa absorção seja o seguinte: os osteoclastos emitem suas projeções semelhantes a vilos em direção ao osso, formando assim a denominada borda pregueada adjacente ao osso.
Os vilos secretam dois tipos de substancias: enzimas proteolíticas e diversos ácidos. As enzimas são liberadas pelos lisossomos dos osteoclastos e os ácidos são derivados do ácido cítrico e ácido lático.
-
Descreva o processo de envelhecimento no tecido ósseo.
Trata-se de um fenômeno relacionado à idade que acomete ambos os sexos e tem como mecanismo predominante uma menor formação óssea, em um contexto no qual sobressai o paratormônio e a vitamina D. Os idosos são potencialmente vulneráveis a um balanço cálcico negativo e à osteopenia/osteoporose em decorrência da hipovitaminose D.
A atrofia óssea com o envelhecimento não se faz de modo homogêneo, pois, antes dos 50 anos, perde-se sobretudo osso trabecular, após essa idade, principalmente osso. A cada 7 a 10 anos “renovamos” todo nosso esqueleto.
A perda de massa óssea por involução ocorre sobretudo na mulher pós-menopausada (quando a falta do freio estrogênico libera a voracidade dos osteoclastos) e no velho; trata-se de um fenômeno relacionado à idade que acomete ambos os sexos e tem como mecanismo predominante uma menor formação óssea, em um contexto no qual sobressai o paratormônio e a vitamina D.
Os idosos são potencialmente vulneráveis a um balanço cálcico negativo e à osteopenia/osteoporose em decorrência da hipovitaminose D. Obtemos a vitamina D por meio de uma adequada alimentação e pela produção endógena da pele sob exposição solar. Dependendo do tempo de exposição solar e do grau de pigmentação da pele, mais de 80% dessa vitamina poderá ser sintetizada a partir do 7-desidrocolesterol da pele. Todavia, muitos fatores contribuem para não termos tal “rendimento” na velhice – dentre eles a institucionalização, uma menor mobilidade, o uso de vários agasalhos, menor exposição voluntária ao sol, maior tempo em interiores etc.
Significativamente, acresça-se a isso o fato de a pele envelhecida produzir menor quantidade de vitamina D do que a pele do adulto jovem. Sabe-se que a pele de indivíduos com 70 anos ou mais produz apenas 25 a 30% de vitamina D em comparação com a quantidade produzida pela pele jovem.
Também se observa uma monotonia alimentar, que quase sempre peca no consumo de alimentos ricos em vitamina D. Destaque-se ainda que há associação direta entre déficits dessa vitamina, condições de fraqueza muscular e depressão na velhice, além de se discutirem cada vez mais suas ações não relacionadas ao metabolismo osteomineral, uma vez que seus receptores (VDR – receptores de vitamina D) estão presentes em várias células/tecidos de diferentes órgãos (fígado, estômago, intestino, rins, músculos, tireoide, alvéolos pulmonares, mamas e neurônios cerebrais, entre outros) Sabe-se hoje que níveis inadequados de vitamina D têm alta prevalência na velhice, mesmo em países tropicais, como o Brasil.
-
Definir e diferenciar osteopenia e osteoporose. Caracterizar a fisiopatologia da osteoporose.
- Osteopenia
Só é possível diferenciar em relação a osteoporose através da realização de um diagnóstico tendo por base a densidade mineral óssea.
A osteopenia é o termo médico utilizado para designar a baixa densidade óssea que tem como consequência grave a osteoporose. Esse termo nem sempre está associado a doença, pois existem pessoas que naturalmente tem baixa densidade óssea.
Também pode ser acompanhada de doenças endócrinas.
- Osteoporose
É uma doença caracterizada pela alteração da qualidade óssea e por sua baixa massa, podendo levar ao desenvolvimento de fraturas atraumáticas em homens e mulheres. A fratura não traumática tem sido definida como decorrente de um trauma causado por uma queda da própria altura ou de menor intensidade. No estado pré-clínico, a OP é caracterizada simplesmente pela baixa massa óssea sem fraturas, e, geralmente, é assintomática, não levando o paciente e o médico ao diagnóstico precoce.
As fraturas osteoporóticas afetam qualquer parte do esqueleto, exceto o crânio. Ocorrem mais comumente na porção distal do antebraço (fratura de Colles), vértebras torácicas e lombares e no fêmur proximal. O aumento da morbidade e da mortalidade pela OP está associado a custos econômicos significativos relacionados com a hospitalização, cuidados ambulatoriais, institucionalização, incapacidades e mortes prematuras.
A osteoporose é uma desordem esquelética crônica e progressiva, de origem multifatorial, que acomete principalmente pessoas idosas, tanto homens quanto mulheres, geralmente após a menopausa. Caracteriza-se por resistência óssea comprometida, predispondo ao aumento do risco de fratura, à dor, à deformidade e à incapacidade física. A resistência óssea reflete a integração entre densidade e qualidade óssea, que, por sua vez é determinada por vários fatores: microarquitetura trabecular interna, taxa de remodelamento ósseo, macroarquitetura, acúmulo de microdanos, grau de mineralização e qualidade da matriz.
A OP é classificada como primária, subdividida em tipos I e II, ou secundária:
- Primária tipo I
- Predominantemente em mulheres, associada à menopausa
- Perda acelerada do osso trabecular
- Fraturas vertebrais comuns
- Primária tipo II
- Ocorre tanto em mulheres quanto em homens idosos
- Compromete ossos cortical e trabecular
- Ocorrência de fraturas vertebrais e de fêmur
- Secundária
- Endocrinopatias (tireotoxicose, hiperparatireoidismo e hipogonadismo)
- Fármacos (glicocorticoides antiácidos, hormônio tireoidiano, anticonvulsivantes)
- Doenças genéticas (osteogenesis imperfecta)
- Artrite reumatoide
- Doenças gastrintestinais
- Imobilização prolongada
- Câncer de mama
- Anemias crônicas
- Fisiopatologia da Osteoporose
O osso é uma forma rígida de tecido conjuntivo, formado por células, osteócitos, osteoblastos e osteoclastos. Os osteócitos encontram-se embebidos em uma matriz proteica de fibras colágenas impregnadas de sais minerais, especialmente de fosfato de cálcio.
A matriz apresenta-se, na fase orgânica, constituída de colágeno, proteínas e glicosaminoglicanos; na fase inorgânica, encontram-se, principalmente, hidroxiapatita (fosfato de cálcio) e menores quantidades de outros minerais. Os osteoblastos e os osteoclastos estão no periósteo e no endósteo, formando a matriz óssea.
As fibras colágenas dão elasticidade, e os minerais, resistência. Na infância, dois terços da substância óssea são formados por tecido conjuntivo. Na velhice, são os minerais que predominam. Essa transposição de conteúdo leva a menor flexibilidade e aumenta a fragilidade do osso. Na composição do esqueleto, há aproximadamente 80% de osso cortical ou compacto, com funções mecânica e protetora, portanto mais resistente, e 20% de osso trabecular ou esponjoso, mais frágil, responsável pela função metabólica.
Na menopausa, as mulheres experimentam uma fase acelerada e transitória, que coincide com as quedas acentuadas do estrógeno, perdendo principalmente osso trabecular e resultando em osteoporose tipo 1. Após essa fase, há uma fase de perda óssea lenta e contínua, semelhante à perda óssea em homens idosos, afetando tanto o osso trabecular quanto o osso cortical e resultando em osteoporose tipo 2. Enquanto a osteoporose pós-menopausa foi reconhecida nesta época, por ser causada por deficiência de estrógeno, a osteoporose senil foi atribuída apenas a processos do envelhecimento, incluindo a disfunção dos osteoblastos.
Embora os homens idosos não tenham uma queda acentuada de hormônios sexuais como ocorre inicialmente nas mulheres pós-menopausa, o envelhecimento masculino está associado ao aumento do nível sérico da globulina ligadora de hormônios sexuais (SHBG), o que diminui a disponibilidade de testosterona e estrógenos livres e ativos (não ligados à SHBG). Apesar de a causa do aumento de SHBG em idosos não estar totalmente elucidada, ela parece estar relacionada à diminuição dos níveis do IGF-1, que inibe a produção de SHBG pelos hepatócitos. Além da deficiência de estrógeno, outro mecanismo importante e potencializador da osteoporose involucional é a deficiência de vitamina D. Nesse sentido, as alterações que acompanham o envelhecimento, como a diminuição da síntese cutânea de vitamina D3(34) e a redução da metabolização da 25-hidroxivitamina D em 1,25 dihidroxivitamina D (calcitriol), por diminuição da atividade da 1α-hidroxilase renal, resultam em baixos valores séricos de vitamina D (35) . Essa deficiência de vitamina D no idoso leva à diminuição da absorção de cálcio intestinal, com redu- ção do cálcio sérico e consequente hiperparatireoidismo secundário elevando a perda óssea.
-
Caracterizar a morfologia e a função do tecido cartilaginoso.
A cartilagem articular (CA), produto de secreção dos condrócitos, é formada por uma matriz de colágeno tipo II altamente hidratada, conjuntamente com agregados de proteoglicanos (complexos de proteínas-mucopolissacarídeos; são macromoléculas organizadas em uma complexa estrutura aniônica que lhes possibilita atuar como uma verdadeira mola biológica).
Os proteoglicanos têm rápido ritmo metabólico, ao contrário da quase fixidez do colágeno. O colágeno tipo II – há pelo menos 11 tipos de colágeno descritos – é a mais abundante proteína fibrilar presente na CA, perfazendo cerca de 85% do conteúdo de colágeno existente. Evidências mostram que a síntese e a degradação do colágeno tipo II associam-se com a matriz pericelular e mantém-se em um estado de equilíbrio dinâmico ao longo dos anos, não apresentando as alterações moleculares comumente associadas à osteoartrite. A composição e a organização estrutural entre colágeno e proteoglicanos é o que possibilita as características de resistência, elasticidade e compressibilidade da CA, tecido que amortece e dissipa forças recebidas, além de reduzir a fricção.
-
Descrever o processo de envelhecimento do tecido cartilaginoso.
O envelhecimento cartilaginoso traz consigo um menor poder de agregação dos proteoglicanos, aliado a uma menor resistência mecânica da cartilagem; o colágeno adquire menor hidratação, maior resistência à colagenase e maior afinidade pelo cálcio. A modificação não enzimática de proteínas tissulares por açúcares redutores é uma característica marcante do envelhecimento. No envelhecimento cartilaginoso, a rede colágena torna-se cada vez mais rígida, paralelamente ao fato de apresentar níveis elevados de pentosidina, cujos produtos finais de glicação acumulam-se com a idade.
Os condrócitos sofrem a ação reguladora de mediadores pré-catabólicos (metaloproteases e citocinas que promovem a degradação cartilaginosa) e pró-anabólicos (fatores de crescimento que ativam mecanismos de regeneração). Os principais agentes da degradação cartilaginosa são as metaloproteases (MMP), enzimas zinco-dependentes distribuídas em 3 grupos: colagenase, gelatinase e estromelisina; bloqueando suas ações temos os inibidores tissulares das MMP. Das citocinas, destaque-se a ação catabólica da interleucina-1 (a mais importante!), da interleucina-6 e do TNF-a (fator de necrose tumoral alfa). Dos fatores anabólicos, destaquem-se as ações do IGF-1 (insulin-like-growth factor-1) e do TGF-b (transforming growth factor-b) na formação de cartilagem articular e na síntese de proteoglicanos.
Com o envelhecimento da CA reconhecem-se muitas alterações na estrutura do agrecano e dos agregados multimoleculares que ele forma com o hialuronato, fruto de processos anabólicos e catabólicos geridos por eventos celulares e extracelulares, em uma extensão que varia segundo o tipo, a articulação, o local e a profundidade considerada.
Sabe-se que os condrócitos de idosos têm menor capacidade de proliferação e possibilidade reduzida de formar tecido novo. A CA tem uma capacidade reparadora limitada, que mais ainda se estreita com o envelhecimento e/ou quando da eclosão de condições degenerativas. A função reparadora dos condrócitos diminui progressivamente com a idade, o que é demonstrado por uma síntese decrescente de agrecanos e por uma menor capacidade para a formação de agregados moleculares de grande tamanho; demonstrou-se também que estresses oxidativos contribuem para a senescência dos condrócitos (fato que explica, em parte, o maior risco de osteoartrite com a idade).
Assim, é a idade do indivíduo a principal responsável pela composição da cartilagem. Compreende-se o porquê de serem as doenças articulares as mais frequentes na velhice. Nos discos intervertebrais a degeneração aumenta com o envelhecimento, estando aumentados a fibronectina e seus fragmentos, substâncias que estimulam as células para a produção de metaloproteases e citocinas que inibem a síntese de matriz intercelular.
-
Diferenciar artrite e artrose. Caracterizar a fisiopatologia da osteoartrite.
O termo Artrite é utilizado para definir uma alteração inflamatória que acomete a articulação. A artrite (inflamação da articulação) pode ser sintoma de inúmeras doenças, sendo sempre de vital importância o diagnóstico da doença que originou a inflamação.
Os termos Osteoartrose, Osteoartrite e Artrose definem uma mesma doença que chega a acometer até 30% da população adulta acima dos 50 anos. Artrose, também chamada de osteoartrite, osteoartrose ou artrite degenerativa, é uma artrite que ocorre por degeneração das cartilagens das articulações.
- Osteoartrite
A doença articular degenerativa/osteoartrite (AO)/osteoartrose é de longe a enfermidade musculoesquelética mais comum nos indivíduos com mais de 65 anos. A OA é considerada uma insuficiência da articulação, com o comprometimento de todas as estruturas que as formam.
- Fisiopatologia da osteoartrite
A cartilagem articular normal é composta por fluido intersticial, elementos celulares e moléculas da matriz extracelular. Cerca de 70% da cartilagem é constituída por água, e essa porcentagem aumenta com a progressão da osteoartrite. As células presentes na cartilagem são os condrócitos, e as moléculas que compõem a matriz cartilaginosa são sintetizadas por eles, dentre as quais as proteínas, representadas principalmente pelos diferentes tipos de colágenos, particularmente o do tipo II, que além de abundante é específico da cartilagem, a elastina, a fibronectina e os complexos polissacarídios. Dentre os complexos polissacarídeos, os proteoglicanos são os mais importantes. Essa composição é que confere à cartilagem suas propriedades de reversibilidade às deformidades e de elasticidade. A função desse tecido é absorver os impactos sobre a articulação e possibilitar um deslizamento suave entre as duas extremidades ósseas justapostas.
A patogenia da OA envolve os processos de destruição e reparação da cartilagem visto que a remodelação é um processo contínuo na cartilagem normal. Os elementos da matriz são constantemente degradados por enzimas autolíticas e repostos por novas moléculas pelos condrócitos. Na OA, esse processo é alterado e, em consequência disso, há um desequilíbrio entre a formação e a destruição da matriz, com um aumento desta última. Na OA, os condrócitos têm papel chave no equilíbrio entre a produção e a degradação da matriz cartilaginosa e, por consequência, da manutenção da função da cartilagem. São responsáveis pela síntese dos elementos da matriz extracelular (MEC) como já descrito, mas também são eles os responsáveis pela produção das enzimas proteolíticas que as quebram, as metaloproteinases (MMP), tais como a MMP-1, MMP-3, MMP-8 e MMP-13, além das agrecanases, a desintegrina e a metaloproteinase com trombospondina-4 e 5 (ADAMTS). Os condrócitos indicam citocinas pró-inflamatórias, como a IL-1b e o TNF-a e fatores de crescimento, como o TGF-b. Normalmente, a produção e a destruição da matriz encontram-se em perfeito equilíbrio. Quando fatores mecânicos, que induzem o aumento da expressão de citocinas inflamatórias, e biológicos atuam rompendo esse equilíbrio, com predomínio da destruição, surge então a OA. Assim, a OA é resultante da quebra desse equilíbrio. A perda local de proteoglicanos e da molécula do colágeno tipo II ocorre inicialmente na superfície da cartilagem, levando a um aumento no conteúdo de água e perda da força de tensão da MEC na medida em que a lesão progride. No líquido sinovial, os novos elementos que são sintetizados são mecanicamente inferiores aos originais e, portanto, são mais suscetíveis às lesões. O processo pode ser iniciado por uma série de eventos que acarretam a alteração da função do condrócito, com fortes evidências de que os estímulos aos condrócitos seriam ocasionados por citocinas pró-inflamatórias, especialmente a IL-1b e o TNF-a. Os condrócitos liberam enzimas proteolíticas (proteinases neutras, catepsina e metaloproteinases), que degradam os elementos da matriz cartilaginosa, causando adelgaçamento da cartilagem e deterioração da sua qualidade mecânica. A velocidade de liberação dessas enzimas e a consequente destruição das moléculas da matriz são significativamente maiores na cartilagem osteoartrítica do que na cartilagem normal (Bland e Cooper, 1984).
A perda da força de tensão para suportar cargas leva à transmissão de uma força maior aos condrócitos e ao osso subcondral. Os condrócitos sob ação dessas forças liberam mais enzimas proteolíticas. O osso subcondral desenvolve microfraturas, causando endurecimento e perda da reversibilidade à compressão. Alguns produtos resultantes da quebra da cartilagem e os proteoglicanos podem estimular a resposta inflamatória, perpetuando o ciclo destrutivo.
Embora a degeneração da cartilagem caracterize a OA, há evidências cada vez maiores que sugerem que as alterações na OA também envolvem a participação da membrana sinovial, principal fonte de citocinas pró-inflamatórias, e do osso subcondral. A esclerose do osso subcondral parece ser mais intimamente relacionada ao início ou à progressão da OA do que meramente uma consequência da doença. Evidências clínicas e laboratoriais mostram que o metabolismo do osso subcondral está alterado na OA, provavelmente decorrente do comportamento anormal dos osteoblastos nessa região. Essa anormalidade aliada ao estresse químico e mecânico provoca o aumento da formação óssea nessa área, elevando a pressão mecânica na cartilagem de articulações de carga e promovendo maior deterioração e surgimento de erosões. Além disso, o papel de mediadores locais produzidos pelos osteoblastos (como o sistema do fator de crescimento insulina-(like [IGF] e o ativador de plasminogênio/plasmina) vem se tornando mais importante.
Na OA, a IL-1b e o TNF-a, bem como as metaloproteinases, desempenham um papel central na intermediação dos seus mecanismos fisiopatogênicos. O desenvolvimento de moléculas que possam bloqueá-las, particularmente as metaloproteinases, tem sido buscado; no entanto, até o presente momento os resultados não são muito animadores.
-
Descrever a cascata do ácido araquidônico. Onde os anti-inflamatórios irão atuar? Falar do uso crônico dos anti-inflamatórios. Identificar medidas não farmacológicas no tratamento da osteoartrite.
- MECANISMO DOS AINES E ESTEROIDES
Os principais representantes do grupo dos eicosanóides inibidos pelos AINEs são as prostaglandinas, as prostaciclinas e os tromboxanos. Os AINEs, basicamente, atuam sobre as enzimas prostaglandinas sintetases, mais conhecidas como ciclooxigenase-1 (COX-1), com ampla distribuição tecidual, e sobre a ciclooxigenase-2 (COX-2) cujo gene, apesar de possuir distribuição tecidual semelhante, na maioria dos casos, somente é expresso em condições patológicas.
O pensamento completo era de que, se a expressão do gene da enzima COX-2 necessitava da indução de mediadores químicos inflamatórios, provavelmente, seria através dela que, num segundo momento da reação inflamatória, as taxas de eicosanóides seriam mantidas. Por outro lado, sendo conhecidas muitas ações fisiológicas da COX-1, os eicosanoides produzidos por ela seriam os iniciadores desta resposta.
Seguindo este raciocínio, após a etapa inicial da inflamação, a presença dos eicosanoides seria mediada tanto pela COX-1, como pela COX-2. Como eram desconhecidas as ações fisiológicas da COX-2, o pensamento resultante era que a sua inibição causaria menos efeitos paralelos (colaterais) do que a inibição indistinta das duas isoformas feitas pelos AINEs convencionais.
Isto levou à busca de drogas inibidoras seletivas da COX-2 e a sua introdução no mercado. Logo após trabalhos de farmacovigilância demonstraram relação entre o uso deste tipo de AINEs com o surgimento de efeitos cardíacos. Em alguns tecidos, a cicloxigenase-2, também, era constitutiva, ou seja, também, exercia atividades fisiológicas, principalmente, sobre a fisiologia cardíaca.
Os anti-inflamatórios esteroidais (AIEs) são drogas que mimetizam os efeitos do hormônio cortisol. Os receptores deste hormônio são intracelulares do tipo IV. Seus principais efeitos estão relacionados à indução ou inibição da transcrição gênica, com reflexos diretos sobre o sistema cardiovascular, endócrino, urinário, digestório e o metabolismo de forma geral. As atividades anti-inflamatórias e imunossupressoras são apenas mais uma de suas ações.
Os produtos finais da transcrição gênica (proteínas) inibidos ou induzidos pela ação do cortisol, na maioria das vezes, são chaves de importantes vias enzimáticas. Exemplo importante de expressão gênica induzida pelo cortisol é a do gene de uma proteína denominada genericamente de lipocortina.
A sua principal ação sobre o processo inflamatório é inibir a enzima fosfolipase A2. Na via bioquímica da síntese de eicosanóides, ela está um nível acima das cicloxigenases e lipooxigenases. Como resultado da sua atividade, ocorre a liberação do ácido araquidônico no meio intracelular que, então, pode ser metabolizado tanto pela via das prostaglandinas sintetases, como pelas vias das lipooxigenases (LOX).
A inibição da fosfolipase A2 mediada pelos corticóides (ou AIEs) diminui a concentração do ácido araquidônico para ser processado pelas COXs e LOXs e, assim, ao mesmo tempo, inibe ambas as vias. É através da restrição de substratos para estas duas enzimas que tanto o cortisol (natural e endógeno) como os seus análogos sintéticos, os corticosteroides (exógenos) exercem sua atividade anti-inflamatória.
Os principais exemplos de inibição da transcrição de genes de proteínas relacionadas ao processo inflamatório mediada pelos AIEs são a inibição da transcrição de citocinas iniciadoras da inflamação, como o interleucinas (IL) 1,2,3 6; interferon-y; fator de necrose tumoral (TNF); algumas quimiocinas e; a expressão das enzimas cicloxigenases. Consequentemente, ocorrem a diminuição do acúmulo e função de células que participam das reações inflamatórias e imunes, como linfócitos, células natural killers, monócitos, macrófagos, eosinófilos, neutrófilos, mastócitos e basófilos. Devido a isso, alguns AIEs estão, também, incluídos na classificação de drogas imunossupressoras.
Apesar do bloqueio da genetranscrição destas citocinas contribuírem para esta última classificação, a mais importante entre elas e a que mais reputa aos AIEs atividades imunossupressoras é o bloqueio da expressão da interleucina-2. Esta citocina é fundamental na expansão clonal de linfócitos T e B, após sensibilização. Assim, impacto causado pela sua ausência é muito significativo sobre a resposta imune.
- RISCO PROLONGADO DO USO DE AINES E AIES
- AINES
Como alvo dos AINEs são as prostaglandinas sintetases (COX-1, COX-2 e COX-3). Como os produtos finais das vias de síntese destas enzimas (prostaglandinas, prostaciclinas e tromboxanos) possuem atividades funcionais que independem da instalação da inflamação, a sua inibição causará em paralelo impacto sobre a fisiologia normal de estruturas distantes e não relacionadas com o foco inflamatório.
Apenas exemplificando: no estômago, as prostaglandinas são indutoras da síntese e secreção do muco protetor que impede a ação do ácido clorídrico e das enzimas proteolíticas sobre a parede estomacal. Sob a ação dos AINEs, ocorre diminuição desta proteção.
As prostaglandinas atuam, regulando o fluxo sanguíneo para os rins, promovendo a vasodilatação da artéria renal. Sob ação dos AINEs, o fluxo sanguíneo renal é dificultado, pois ocorre vasoconstrição.
Em quadros de insuficiência renal, isto pode assumir proporções desastrosas. A prostaglandina F2α possuí importante papel nas contrações uterinas, durante o trabalho de parto.
Sobre os rins, são mais frequentes a nefrite intersticial, insuficiência renal aguda, retenção de Na+ e edema difuso. Sob o aparelho cardiovascular a descompensação de insuficiência cardíaca (IC) e aumento do risco de eventos aterotrombóticos (expecialmente os coxibs). Além destas, existem, ainda, relatos de desenvolvimento de urticária, angioedema e eritema polimorfo Stevens Johnson com praticamente todos os AINEs.
- AIES
A ação anti-inflamatória dos AIEs dá-se, através da indução da expressão do gene da liporcortina que, depois de sintetizada, inativa a fosfolipase A2. Assim, além de produzir efeitos paralelos semelhantes aos dos AINEs, também, influenciam as ações fisiológicas dos derivados da via das lipooxigenase (ex.: leucotrienos).
Desta forma, os efeitos adversos esperados pela ação dos AIEs estão relacionados à inibição das atividades fisiológicas das prostaglandinas, prostaciclinas, tromboxanos e, também, dos leucotrienos. Além disto, está nos efeitos hormonais dos AIEs a gênese de alguns tipos de diabetes e hipertensão; do ganho de peso iatrogênico, da insuficiência adrenal, de algumas formas de úlceras pépticas, do surgimento de sangramentos digestivos, de estrias no abdome, da osteoporose (provavelmente, por antagonizar efeitos da vitamina D), do surgimento de edemas, da hipopotassemia, da necrose da cabeça do fêmur; do excesso de pelos no corpo, da obesidade tipo central, com o tronco obeso e membros finos, dentre outros.
Dentre os efeitos adversos hormonais, merecem destaque o desenvolvimento de miopatia, retenção de Na+ e H2O (resultando em edema e hipertensão arterial sistêmica – HAS, diabetes sacarino, catarata subcapsular posterior, aumento de pressão intraocular e, em crianças, retardo do crescimento. A sua utilização, por mais de duas semanas, mesmo em pequenas doses, facilita a instalação de infecções pelos mais variados agentes, supressão da glândula suprarrenal (insuficiência) e necrose asséptica de ossos. Sua utilização mais prolongada pode desencadear distúrbios psiquiátricos e Cushing iatrogênico.
- Tratamento não farmacológico
Enquadram-se nessa modalidade, além dos aspectos de educação e envolvimento dos pacientes no seu tratamento, as atividades esportivas moderadas com monitoramento profissional adequado e as orientações quanto à ergonomia ocupacional e doméstica, fundamentais no tratamento da OA. De igual importância são os exercícios terapêuticos (fisioterapia) com destaque para exercícios de reforço muscular, melhora do condicionamento físico global, uso de órteses e equipamentos de auxílio à marcha e utilização crescente de agentes físicos como a termo e a eletroterapia analgésicas.
-
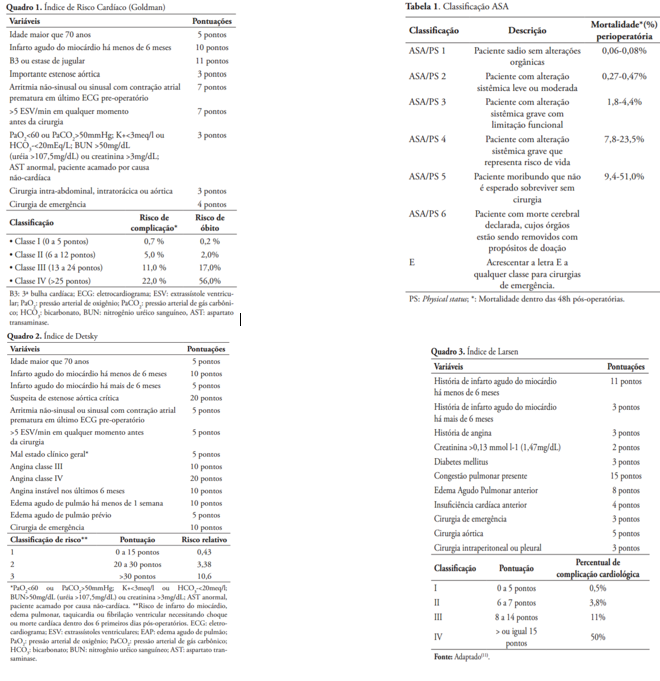
Conceituar avaliação de risco cirúrgico (ASA – Avaliação de Risco Cirúrgico Anestesiologia). Relacionar risco e cirurgia, dependendo de sua gravidade.
Os eventos cardiovasculares são as principais causas de mortalidade perioperatória em cirurgias não cardíacas. Para estimar o risco cardiovascular em cada caso, foram criados diversos escores de risco perioperatório.
Essa avaliação deve ser capaz de estimar possíveis riscos decorrentes do procedimento cirúrgico em cada paciente e, se possível, orientar condutas que possam minimiza-los. Esta estimativa é importante para oferecer ao cirurgião/equipe e paciente/família informação que devem ser levadas em conta na comparação entre possíveis benefícios e malefícios do procedimento em cada caso.
Existem diversas escalas que foram criadas com o objetivo de estimar o risco cardiovascular.
-
Caracterizar o estatuto do idoso e citar políticas públicas de apoio. Identificar dados epidemiológicos sobre fraturas por quedas em idosos.
- Fraturas por quedas em idosos
Dentre as causas externas, os acidentes de transporte envolvendo idosos jovens decorrem do processo de urbanização e da elevada proporção daqueles exercendo atividades profissionais, tendências crescentes. O aumento da proporção de octogenários também deverá aumentar a incidência de quedas e fraturas entre homens idosos frágeis.
Outras causas de internação dos octogenários corroboram o conceito de que idosos mais velhos são mais frágeis. As internações por fraturas superam aquelas por cardiopatia isquêmica, diabetes ou neoplasias. Na realidade, as 68.6 mil internações por fraturas dos idosos com 60 anos ou mais revelam uma epidemia oculta: o resultado da ausência de programas dirigidos à manutenção da massa óssea de mulheres adultas e de prevenção de quedas de idosos.
- Casos de internação de idosos de 60 a 69 anos com fratura de fêmur e ossos
- HOMENS: 2,2% do total (11.612) – taxa de 2,4 homens/1000 habitantes.
- MULHERES: 3% do total (14.266) – taxa de 2,5 mulheres/1000 habitantes.
- TOTAL: 2,6% do total (25.878) – taxa de 2,4 pessoas/1000 habitantes.
- Casos de internação de idosos de 70 a 79 anos com fratura de fêmur e ossos
- HOMENS: 1,7% do total (7.066) – taxa de 2,7 homens/1000 habitantes.
- MULHERES: 3,6% do total (15.143) – taxa de 4,5 mulheres/1000 habitantes.
- TOTAL: 2,6% do total (22.209) – taxa de 3,7 pessoas/1000 habitantes.
- Casos de internação de idosos de mais de 80 anos com fratura de fêmur e ossos
- HOMENS: 2,2% do total (5.328) – taxa de 4,7 homens/1000 habitantes.
- MULHERES: 5% do total (15.175) – taxa de 9,1 mulheres/1000 habitantes.
- TOTAL: 3,8% do total (20.503) – taxa de 7,3 pessoas/1000 habitantes.
- Quedas, fraturas e outras causas externas de morbidade
A instabilidade postural, quedas e fraturas são um tema cada vez mais presente nos estudos sobre idosos no Brasil. A revisão de Pinheiro & Eis identificou mais de 200 estudos sobre osteoporose e fraturas feitos no Brasil, 60 dos quais descrevem a situação epidemiológica atual. Os dados revelam moderada incidência de fratura de quadril em indivíduos acima de 50 anos de idade, mas elevada prevalência de todos os tipos de fratura por fragilidade óssea, variando de 11% a 24%.
Também é elevada a incidência de quedas recorrentes, um dos principais aspectos extraesqueléticos associados às fraturas. No Brasil, 12 meses após a fratura de fêmur, a taxa de mortalidade variou de 21,5% a 30%, com elevada taxa de incapacidade física, deterioração da qualidade de vida e grande impacto sobre o sistema de saúde.
A dificuldade para realizar atividades físicas aumentou o risco de fraturas em cerca de três vezes. Quanto maior a dificuldade, maior o risco. Ser mulher ou referir má visão aumentam o risco de quedas quase duas vezes. Em estudo de caso-controle que avaliou 139 idosos internados por fraturas provocadas por quedas e 265 controles pareados por sexo e idade, observou-se que a demência estava associada à chance quase duas vezes maior de fraturas graves. Quedas de idosos com demência ocorreram principalmente dentro de casa, sendo 1/5 delas no banheiro, a maioria durante o dia.
Um grande estudo transversal avaliou amostra composta por 4.003 idosos (média de 74 anos) vinculados às unidades básicas de saúde de 41 municípios em sete estados do Brasil. A prevalência de quedas entre os idosos foi de 35%, significativamente maior nas mulheres (40,1%). Dentre os que sofreram quedas, 12% tiveram fratura como consequência. A prevalência de quedas associou-se com idade avançada, sedentarismo, e maior número de medicações referidas para uso contínuo.
O Estudo Brasileiro de Osteoporose, de base populacional, avaliou 2.420 indivíduos com idade superior a 40 anos (média = 60 anos) provenientes das cinco regiões do país e de todas as classes socioeconômicas. Teve como objetivo identificar os principais fatores clínicos de risco associados às fraturas por queda da própria altura. Sedentarismo, tabagismo atual, pior qualidade de vida e diabetes melitus foram os fatores clínicos de risco mais relevantes para fratura em homens. Dentre as mulheres, os mais importantes foram idade avançada, menopausa precoce, sedentarismo, pior qualidade de vida, maior consumo de fósforo, diabetes melito, quedas, uso crônico de benzodiazepínicos e história familiar de fratura de fêmur após os 50 anos em parentes de primeiro grau.


















Comentários