Questões
- Descrever a fisiopatologia do câncer de próstata.
- Relacionar a fisiopatologia do câncer de próstata com as manifestações clínicas.
- Identificar os fatores de risco e a epidemiologia do câncer de próstata.
- Caracterizar os diagnósticos diferenciais do câncer de próstata (prostatite, hiperplasia benigna de próstata), identificando os achados clínicos e laboratoriais que subsidiem a identificação.
- Citar as formas de prevenção e detecção precoce do câncer de próstata, relacionadas às políticas públicas de saúde.
- Reconhecer a herança genética envolvida neste tipo de tumor.
- Explicar o significado clínico da escala de Gleason na avaliação do tumor de próstata.
- Conceituar metástases, explicar como elas ocorrem e discutir seus significados na evolução de uma neoplasia.
- Citar as possibilidades terapêuticas do câncer de próstata.
- Caracterizar o estadiamento do câncer de próstata.
Respostas
-
Descrever a fisiopatologia do câncer de próstata.
- Adenocarcinoma de próstata
O adenocarcinoma da próstata é a forma mais comum de câncer em homens, representando 29% dos casos de câncer nos Estados Unidos em 2007. Contudo, o câncer de próstata está associado ao câncer colorretal em termos de mortalidade por câncer, causando 9% das mortes por câncer nos Estados Unidos em 2007. Existe a probabilidade de uma em seis ao longo da vida de receber um diagnóstico de câncer de próstata. Nos últimos 20 anos, houve uma queda significativa na mortalidade por câncer de próstata. Este é um dos tumores mais notáveis, exibindo uma grande variedade de comportamentos clínicos que variam de cânceres letais muito agressivos até cânceres insignificantes descobertos acidentalmente.
O câncer da próstata tipicamente é uma doença de homens acima de 50 anos de idade. Contudo, em homens que apresentam maior risco, recomenda-se que a triagem para câncer de próstata seja iniciada aos 40 anos. Também deve ser considerada a triagem de todos os homens aos 40 anos e novamente aos 45 para detectar casos raros de homens jovens com câncer de próstata antes que a doença se torne incurável. A incidência do câncer de próstata na necropsia é bastante alta. Ela aumenta de 20% em homens na faixa dos 50 para aproximadamente 70% em homens entre 70 e 80 anos de idade. Existem algumas diferenças nacionais e raciais notáveis e intrigantes na incidência da doença. 100 O câncer prostático é raro em asiáticos e ocorre mais frequentemente entre negros. Além dos fatores hereditários, o ambiente desempenha um papel importante, como evidenciado pela elevação da incidência da doença em japoneses imigrantes para os Estados Unidos, embora não tão próxima do nível de americanos nativos. Além disso, à medida que a dieta na Ásia tem se tornado ocidentalizada, a incidência de câncer de próstata clinicamente significativo nesta região do mundo parece estar aumentando. Ainda não está claro se isto é decorrente de fatores dietéticos ou outras alterações do estilo de vida.
Adenocarcinoma é a neoplasia maligna constituída pela proliferação de células epiteliais dos ácinos e/ou ductos prostáticos. Quanto ao comportamento biológico, a neoplasia é classificada nos seguintes tipos:
- Adenocarcinoma clínico
É o que dá manifestações locais, e levanta suspeita da sua existência por achados clínicos. Se não for tratado, evolui com infiltração local e metástases, podendo levar o paciente à morte.
2. Adenocarcinoma latente
Também chamado dormente ou indolente, é um adenocarcinoma apenas histológico que não evolui necessariamente para carcinoma clínico ou, mais provavelmente, evolui de modo muito mais lento. Pode ser encontrado incidentalmente em autópsia, RTU ou prostatectomia aberta para tratamento de HNP e em biópsias por agulha. Por ser o adenocarcinoma latente muito pequeno, o paciente não tem manifestações clínicas. Esta forma peculiar de neoplasia é quase exclusiva da próstata. O adenocarcinoma latente é muito mais frequente do que o adenocarcinoma clínico.
3.Adenocarcinoma oculto
Corresponde ao adenocarcinoma clínico cujas manifestações decorrem das metástases e não do crescimento local da neoplasia. O adenocarcinoma oculto não é o mesmo que adenocarcinoma latente (este é assintomático).
Etiologia
Tal como ocorre para a maioria dos cânceres, a etiologia do carcinoma prostático é em grande parte desconhecida. No entanto, alguns fatores parecem ser importantes.
Inquestionavelmente, é um fator associado tanto ao adenocarcinoma clínico como ao adenocarcinoma histológico. A maioria dos pacientes com adenocarcinoma clínico encontra-se na 7ª ou 8ª décadas de vida; a frequência de adenocarcinoma histológico aumenta com a idade, chegando a ser de cerca de 70% em indivíduos com mais de 80 anos.
O adenocarcinoma da próstata é mais frequente em brancos e negros do que em amarelos, particularmente japoneses; nos EUA, também é mais comum em negros do que em brancos. Tais diferenças raciais são observadas apenas no carcinoma clínico, pois a frequência de adenocarcinoma histológico é semelhante nas três raças.
Nos receptores de andrógeno (AR), há um gene relacionado ao cromossomo X que contém sequência polimorfa composta por repetição de códon que codifica glutamina (CAG) e que varia entre as raças na seguinte proporção crescente: negros, brancos e asiáticos (menor incidência de câncer de próstata).
Ingestão de grandes quantidades de gordura de origem animal pode aumentar a incidência do CP, uma vez que este nutriente elevaria as taxas de androgênios e estrogênios, os quais, por sua vez, induziriam ao desenvolvimento de tumores da próstata. Estudo com camundongos portadores de câncer prostático que receberam dieta com 40% e 2,3% de gordura, demonstraram que após decorrido algum tempo, o volume do tumor foi três vezes maior nos animais que receberam dieta com 40% de gordura, do que naqueles que receberam dieta com 2,3%.
Embora ainda pouco documentados, parecem estar envolvidos em 90% dos adenocarcinomas que surgem em indivíduos abaixo de 55 anos de idade. Em algumas famílias, a herança é de padrão autossômico dominante; nesses casos, o risco de um homem desenvolver adenocarcinoma prostático se o pai ou um irmão tiverem o tumor é duas vezes maior e, se ambos o têm, nove vezes maior.
Nos casos hereditários, os antecedentes familiares têm particular importância por elevarem o risco de ocorrência precoce da patologia. A existência de um antepassado com câncer supõe um risco duas vezes superior ao da população em geral. O risco aumenta 1,5 vezes quando um parente de primeiro grau (pai ou irmão) tem o tumor, cinco vezes quando são acometidos dois parentes de primeiro grau e 10,9 vezes quando três parentes de primeiro grau têm a doença. Recentemente, estudando 66 famílias com alta prevalência do CP, pesquisadores suecos identificaram no braço longo do cromossomo I o local onde, provavelmente, se aloja o principal proto-oncogene causador do câncer prostático, o HPCI “Hereditary Prostate Câncer I”. Tal descoberta permitirá, em futuro próximo, que um simples teste laboratorial de análise de DNA identifique indivíduos propensos a ter CP. Em médio prazo, é possível que os médicos possam intervir sobre este gene, neutralizando-o e impedindo a degeneração maligna das células.
Os andrógenos são necessários para o crescimento e o desenvolvimento da próstata normal, da hiperplasia benigna e do adenocarcinoma prostático. Indivíduos castrados antes da puberdade têm risco mínimo de desenvolver câncer da próstata. Alguns estudos clínicos mostram que andrógenos circulantes em níveis aumentados são capazes de estimular o crescimento de câncer prostático (por estímulo androgênico, o volume tumoral pode aumentar).
Não se conhece, entretanto, o papel exato dos andrógenos na carcinogênese da próstata. Paradoxalmente, com o avançar da idade os níveis de testosterona (T) diminuem, enquanto a incidência de carcinoma prostático aumenta. Uma explicação é que os eventos carcinogênicos que requerem ou envolvem estimulação androgênica teriam ocorrido muito antes do aparecimento da neoplasia, num momento em que os níveis de testosterona ainda eram elevados. Outra possibilidade é maior disponibilidade dos receptores de andrógenos nas células prostáticas, possivelmente por amplificação dos genes que os codificam. De qualquer modo, a influência androgênica em nível tecidual local é controversa. Para alguns autores, as células neoplásicas da próstata contêm relativamente mais testosterona e menos di-hidrotestosterona (DHT).
Os estrógenos, em princípio, parecem não ter ação direta, mas podem atuar através da inibição da liberação do hormônio luteinizante (LH) pela adenohipófise (mecanismo de feedback negativo), resultando em diminuição dos níveis de andrógenos. Na senilidade, há aumento relativo de estrógenos por diminuição dos andrógenos circulantes. Apoiando essa possível ação dos estrógenos, existe a observação de menor incidência de adenocarcinoma prostático clínico em indivíduos com cirrose hepática.
Os andrógenos desempenham um papel importante no câncer de próstata. Como seus equivalentes normais, o crescimento e a sobrevida das células do câncer de próstata dependem de andrógenos, que se ligam ao receptor androgênico (AR) e induzem a expressão de genes pró-crescimento e pró-sobrevida. É interessante observar, em relação às diferenças no risco de câncer de próstata entre as raças, que o gene do receptor androgênico relacionado ao cromossomo X contém uma sequência polimorfa composta por repetições do códon CAG (que codifica a glutamina). Contudo, mesmo em indivíduos normais, existe variação suficiente na extensão de repetições CAG para afetar a função do receptor androgênico. Receptores androgênicos com extensões mais curtas de poliglutamina apresentam maior sensibilidade aos andrógenos. As repetições mais curtas de poliglutamina são encontradas, em geral, em afroamericanos, enquanto caucasianos possuem uma extensão intermediária e os asiáticos possuem a mais longa, o que corresponde à incidência e à mortalidade por câncer de próstata nestes grupos. Mais diretamente, a extensão das repetições está inversamente relacionada à frequência na qual o câncer de próstata se desenvolve em modelos murinos.
A importância dos andrógenos na manutenção do crescimento e sobrevida das células do câncer de próstata pode ser observada no efeito terapêutico da castração ou do tratamento com antiandrogênicos, que geralmente induzem regressão da doença. Infelizmente, a maioria dos tumores eventualmente se torna resistente ao bloqueio androgênico. Os tumores escapam por uma variedade de mecanismos, incluindo uma hipersensibilidade em níveis baixos de andrógeno (por exemplo, amplificação do gene de AR), mutações no receptor androgênico que permitem sua ativação por ligandos não androgênicos e outras mutações ou alterações epigenéticas que ativam as vias de sinalização alternativas, que podem evitar completamente a necessidade de receptor androgênico. Entre estas últimas estão as alterações que promovem um aumento da ativação da via de sinalização P1-3 quinase/AKT, que é observada mais frequentemente em tumores que se tornaram resistentes à terapia antiandrogênica.
Existe um grande interesse no papel de outros polimorfismos hereditários no desenvolvimento do câncer de próstata. Em comparação aos homens sem história familiar, aqueles que possuem parentes de primeiro grau com câncer de próstata apresentam o dobro de risco e aqueles com dois parentes de primeiro grau possuem cinco vezes o risco de desenvolver câncer de próstata. Homens com uma forte história familiar de câncer de próstata também tendem a desenvolver a doença em idade mais precoce. Homens com mutações de linha germinativa do supressor tumoral BRCA2 possuem um risco 20 vezes maior de desenvolver câncer de próstata, e uma mutação hereditária no HOXB13, um gene homeobox que codifica um fator de transcrição que regula o desenvolvimento da próstata, também confere um risco substancialmente aumentado na pequena porcentagem de famílias que os carrega. Entretanto, a vasta maioria dos canceres de próstata familiares é decorrente de variações em outros loci, que conferem um pequeno aumento no risco de câncer. Estudos de associação ampla entre família e genoma identificaram mais de 40 loci associados ao risco, que explicam cerca de 25% do risco familiar. De possível interesse, vários genes propostos nessas regiões estão envolvidos na imunidade inata, levando à especulação de que a inflamação, uma característica emergente do câncer, pode preparar o cenário para o desenvolvimento do carcinoma prostático.
Outros trabalhos focalizam o papel de mutações adquiridas e alterações epigenéticas especificas para o tumor. Uma mudança genética estrutural muito comum no câncer de próstata são os rearranjos cromossômicos que justapõem a sequência de codificação do gene de um fator de transcrição da família ETS (mais comumente ERG ou ETV1) próximo ao promotor TMPRSS2 regulado por androgênio. Esses rearranjos, que ocorrem em aproximadamente metade dos casos de câncer de próstata em coortes caucasianas, colocam o gene ETS envolvido sob o controle do promotor TMPRSS2 e levam a sua superexpressão de modo dependente de andrógenos. A superexpressão dos fatores de transcrição ETS não transforma diretamente as células epiteliais da próstata, mas torna as células epiteliais prostáticas normais mais invasivas, possivelmente pela suprarregulação das metaloproteases da matriz. O significado clinico desses rearranjos genéticos ainda não está claro, dado que a maioria dos estudos mostra que em coortes tratadas cirurgicamente a presença de rearranjo de genes ETS por si só não prediz um pior prognóstico.
Em contraste com o câncer de mama e o de cólon, os esforços recentes de sequenciamento do genoma completo têm demonstrado que as deleções e amplificações genômicas são mais comuns no câncer da próstata do que mutações pontuais envolvendo oncogenes. Alterações genéticas mais comuns no câncer de próstata incluem amplificação do locus 8q24 contendo o gene MYC e deleções envolvendo o supressor tumoral PTEN. Nos estágios avançados da doença são comuns tanto a perda de TP53 (por deleção ou mutação) como deleções envolvendo RB, dado que são ampliações do locus do gene do receptor de androgênio.
A alteração epigenética mais comum no câncer de próstata é a hipermetilação no gene da glutationa S-transferase (GSTP1) que infrarregula a expressão de GSTP1. O gene GSTP1 está localizado no cromossomo 11q13 e é uma parte importante da via que previne a lesão decorrente de uma grande variedade de carcinógenos. Outros genes silenciados por modificações epigenéticas em um subgrupo de cânceres de próstata incluem vários genes supressores de tumor, incluindo genes envolvidos na regulação do ciclo celular (RB, CDKN2A), na manutenção da estabilidade genômica (MLH1, MSH2) e na supressão da via de sinalização Wnt (APC).
Pode ser presumido a partir da multiplicidade de anormalidades, que o carcinoma prostático (como outros cânceres) é o produto de uma combinação crítica de mudanças estruturais genômicas adquiridas, mutações somáticas e alterações epigenéticas. Uma suposta lesão precursora, a neoplasia intraepitelial prostática (PIN), foi descrita. Existem várias evidencias que relacionam PIN ao câncer invasivo. Em primeiro lugar, tanto a PIN quanto o câncer tipicamente predominam na zona periférica e são relativamente raros em outras regiões. As próstatas contendo câncer possuem maior frequência e maior extensão de PIN, que frequentemente também é observada próxima ao câncer. Estudos revelaram que muitas das alterações moleculares observadas nos cânceres invasivos estão presentes em PIN (por exemplo, reorganizações envolvendo os genes ETS são encontradas em um subgrupo), sugerindo fortemente o argumento de que PIN é precursora do câncer invasivo. Apesar de todas as evidências, não conhecemos a história natural da PIN e em particular com que frequência ocorre a progressão para o câncer. Portanto, ao contrário do câncer de colo de útero, o termo “carcinoma in situ” não é usado para PIN.
Referência Bibliográfica:
- ROBBINS & COTRAN. Patologia: Bases patológicas das doenças. 8ª Edição. Rio de Janeiro: Elsevier, 2016. 1458 p.
- CÂNCER DE PRÓSTATA: UMA REVISÃO DA LITERATURA. Thiarles Cristian Aparecido Tonon, João Paulo Ferreira Schoffen.
- BOGLIOLO, L.; BRASILEIRO FILHO, G. Patologia. 8ªed. Rio de Janeiro: Guanabara Koogan, 2011.
2. Relacionar a fisiopatologia do câncer de próstata com as manifestações clínicas.
O câncer de próstata precoce não causa sintomas. Geralmente é diagnosticado após um teste de PSA elevado. Às vezes, entretanto, o câncer de próstata causa sintomas semelhantes aos da hiperplasia prostática benigna. Estes sintomas incluem polaciúria, noctúria (urinar mais à noite), dificuldade em iniciar e manter um jato contínuo de urina, hematúria (sangue na urina) e disúria (ato de urinar doloroso). O câncer de próstata pode também causar problemas com a função sexual, como dificuldade em atingir uma ereção ou ejaculação dolorosa.
O câncer avançado pode se disseminar pelo corpo, provocando sintomas diferentes dos urinários. Dores no períneo, alterações do funcionamento intestinal, dores ao nível dos rins e nos ossos, cansaço, perda de força e de peso, são algumas das manifestações clínicas provocadas pela extensão a órgãos vizinhos ou à distância (metástases). Muitas vezes indivíduos apresentam fratura espontânea do fêmur sem qualquer tipo de trauma, o que pode ser considerado uma fratura patológica, esta provocada pela disseminação do tumor prostático.
Referência Bibliográfica:
- ROBBINS & COTRAN. Patologia: Bases patológicas das doenças. 8ª Edição. Rio de Janeiro: Elsevier, 2016. 1458 p.
- BOGLIOLO, L.; BRASILEIRO FILHO, G. Patologia. 8ªed. Rio de Janeiro: Guanabara Koogan, 2011.
3. Identificar os fatores de risco e a epidemiologia do câncer de próstata.
Fatores de risco
- Idade maior ou igual a 50 anos
- História familiar de pai ou irmão com câncer da próstata antes dos 60 anos de idade
- Dieta pode exercer influência sobre a gênese do câncer, porém, ainda é incerto.
- Relação positiva entre o alto consumo energético total e ingestão de carne vermelha, gorduras e leite e o risco de câncer da próstata.
- Substâncias geradas durante o preparo de alguns alimentos, como as aminas heterocíclicas e hidrocarbonetos policíclicos aromáticos têm sido consideradas como componentes da dieta que poderiam aumentar o risco de câncer da próstata
- Consumo excessivo de álcool, tabagismo e a vasectomia
Em relação à dieta, há evidencias de que uma dieta rica em frutas, verduras, legumes, grãos e cereais integrais, e pobre em gordura, principalmente as de origem animal, não só ajuda a diminuir o risco de câncer, como também o risco de outras doenças crônicas não transmissíveis.
Além disso, alguns componentes naturais dos alimentos, como as vitaminas A, D e E e minerais (selênio), possivelmente desempenham um papel protetor.
Epidemiologia
- Quarta causa de morte por neoplasias no Brasil.
- Corresponde a 6% do total de óbitos de homens.
- A taxa de mortalidade bruta vem apresentando acentuado ritmo de crescimento.
- Tanto a incidência como a mortalidade aumentam exponencialmente após a idade de 50 anos.
- Brasil – 2012: 60.180 casos novos (30,8%) – risco estimado de 62 casos novos a cada 100 mil homens.
- O câncer mais incidente entre os homens.
Ref. Bib.: Revista eletrônica acervo saúde. Câncer de próstata: caracterização epidemiológica e riscos hereditários.
4. Caracterizar os diagnósticos diferenciais do câncer de próstata (prostatite, hiperplasia benigna de próstata), identificando os achados clínicos e laboratoriais que subsidiem a identificação.
É feito pelo estudo histopatológico do tecido obtido pela biópsia da próstata, que deve ser considerada sempre que houver anormalidades no toque retal ou na dosagem do PSA.
O relatório anatomopatológico deve fornecer a graduação histológica do sistema de Gleason, cujo objetivo é informar sobre a provável taxa de crescimento do tumor e sua tendência a disseminação.
Os principais métodos diagnósticos para a identificação ou rastreamento do câncer de próstata são a realização do exame de toque digital da glândula, dosagem do antígeno prostático especifico – PSA, ultrassonografia transretal, biópsia e o estudo patológico.
O toque retal juntamente com a dosagem do PSA pode demonstrar indícios da enfermidade, sendo assim indicada a realização de uma ultrassonografia pélvica, ou prostática transretal; os resultados indicarão se há ou não a necessidade da realização de uma biópsia prostática transretal.
A biópsia é aconselhada quando os níveis de PSA ultrapassam 4ng/ml. Porém, o diagnóstico só é feito após a confirmação por meio de estudos histopatológicos realizado com a amostra de tecido obtida pela biópsia prostática.
É dividida em: prostatite bacteriana aguda e crônica, prostatite não bacteriana crônica e prostatite granulomatulosa.
- Prostatite bacteriana aguda
Resulta de bactérias semelhantes àquelas que causam as infecções do trato urinário. A maioria dos casos são causados por diversas cepas E. coli, outros bastonetes gram-negativos, enterococos e estafilococos.
As bactérias se implantam na próstata geralmente por refluxo intraprostático de urina da uretra posterior ou da bexiga urinária, mas ocasionalmente se introduzem na próstata por vias linfo-hematogênicas, a partir de focos de infecção distantes.
Geralmente é tratada por manipulações cirúrgicas da uretra ou da própria glândula prostática, como cauterização, cistoscopia, dilatação uretral ou procedimentos de ressecção na próstata.
Clinicamente associada a febre, calafrios e disúria. Ao exame retal, a próstata é extremamente sensível e mole. O diagnóstico pode ser estabelecido por cultura de urina e pelas características clinicas.
Tanto no caso da aguda ou crônica, biópsias ou amostras cirúrgicas raramente são obtidas, pois, o diagnóstico é feito com base nos achados clínicos e laboratoriais. A biópsia é contraindicada, pois pode aumentar a sepse.
2.Prostatite bacteriana crônica
Difícil de diagnosticas e tratar. Clinicamente apresenta dor lombar, disúria e desconforto perineal e suprapúbico. Pode ser virtualmente assintomática. Os pacientes geralmente têm história de infecção recorrente do trato urinário causadas pela mesma bactéria.
3.Prostatite não bacteriana crônica
Forma mais comum de prostatite; é indistinguível da prostatite crônica bacteriana em termos de sinais e sintomas, mas não há história de infecção recorrente do trato urinário.
Não responde aos antibióticos.
4. Prostatite granulomatosa
Pode ser especifica, quando, um agente infeccioso etiológico pode ser identificado ou inespecífica. A inespecífica é relativamente comum e representa uma reação a secreções de ductos e ácinos prostáticos rompidos.
Etiologia multifatorial, incluindo causas infecciosas e não infecciosas.
- Hiperplasia benigna prostática
É a mais comum doença prostática benigna em homens com mais de 50 anos. Resulta da hiperplasia nodular das células do estroma prostático e células epiteliais, e muitas vezes leva a obstrução urinária.
Se caracteriza pela formação de grandes nódulos, bastante nítidos, na região periuretral da próstata, os quais, quando suficientemente grandes, comprimem e estreitam o canal uretral, causando a obstrução parcial, ou praticamente completa da uretra. Não é considerada uma lesão pré-maligna.
Acredita-se que a HPB se origine principalmente de uma redução da morte celular, resultando no acúmulo de células senescentes na próstata. De acordo com essa hipótese, os andrógenos, que são necessários para o desenvolvimento de HPB, não somente aumentam a proliferação celular, mas também inibem a morte celular.
O principal andrógeno na próstata, constituindo 90% dos andrógenos prostáticos totais, é a di-hidrotestosterona (DHT). A DHT é formada na próstata a partir da testosterona, através da ação de uma enzima chamada 5α-redutase tipo 2. Essa enzima está localizada quase inteiramente em células do estroma. Com exceção de algumas células basais, as células epiteliais prostáticas não expressam a 5α-refuta-se tipo 2. Portanto, as células estromais são responsáveis pelo crescimento prostático dependente de andrógeno. A 5α-redutase tipo 1 não é detectada na próstata ou está presente em níveis muito baixos. Contudo, essa enzima pode produzir DHT a partir de testosterona no fígado e na pele e a DHT circulante pode agir na próstata por um mecanismo endócrino.
A DHT se liga ao receptor de andrógeno (RA) nuclear presente tanto nas células prostáticas estromais quanto nas epiteliais. DHT é mais potente que a testosterona porque possui maior afinidade por RA e forma um complexo mais estável com o receptor. A ligação de DHT com RA estimula a transcrição dos genes dependentes de andrógenos, que inclui vários fatores de crescimento e seus receptores.
Os mais importantes entre esses são os membros da família do fator de crescimento de fibroblastos (FGF, do inglês, fibroblast growth factor) e o fator transformante do crescimento (TGF)-β . FGFs, produzidos por células do estroma, são reguladores parácrinos de crescimento epitelial estimulados por androgênio durante o desenvolvimento prostático embrionário, e algumas dessas vias podem ser ”redespertadas” na idade adulta para produzir o crescimento da próstata na HBP.
O TGF-β serve como um agente mitogênico para fibroblastos e outras células mesenquimais, mas inibe a proliferação epitelial. Embora a causa final da HPB seja desconhecida, acredita-se que os fatores de crescimento induzidos por DHT atuem aumentando a proliferação das células estromais e diminuindo morte das células epiteliais.
Aspectos clínicos:
- Obstrução urinária – decorrente do aumento do tamanho da próstata e a contração da próstata mediada por musculo liso.
- Aumento da resistência ao fluxo urinário.
- Aumento da frequência urinária.
- Noctúria.
- Dificuldade em iniciar e interromper o fluxo de urina.
- Gotejamento pós-miccional.
- Disúria (micção dolorosa).
- Hipertrofia e distensão da bexiga.
- Retenção urinária.
- Incapacidade de esvaziamento completo da bexiga.
- Maior risco de desenvolver infecções bacterianas da bexiga e dos rins.
REFERÊNCIA BIBLIOGRÁFICA: Robbins & Cotran Patologia – Bases patológicas das doenças, 9ED.
5. Citar as formas de prevenção e detecção precoce do câncer de próstata, relacionadas às políticas públicas de saúde.
A prevenção contra o câncer de próstata é feita por meio de dois níveis de programas de prevenção:
Previne a ocorrência da enfermidade. É necessária a limitação da exposição a agentes causais ou fatores de risco como o tabagismo, sedentarismo, dieta inadequada.
Consiste no diagnóstico precoce por meio de rastreamento com o objetivo de reduzir a incidência e prevalência do câncer de próstata
Se faz necessários procedimentos que permitam o diagnóstico precoce ou detecção das lesões pré-cancerosas, cujo tratamento pode levar à cura ou, ao menos, à melhora da sobrevida dos indivíduos acometidos.
As justificativas que norteiam a detecção precoce do câncer da próstata, assim como de qualquer outra topografia, é que quanto mais inicialmente a doença for diagnosticada, maiores serão as chances de cura, além de permitir um tratamento menos agressivo e mutilante.
A detecção precoce do câncer da próstata poderia reduzir os altos custos decorrentes do tratamento do câncer em estádios avançados ou da doença metastática. Um dos maiores desafios na detecção precoce deste câncer é a falta de conhecimentos sobre a história natural, portanto, não há evidencias ou conhecimentos suficientes que permitem estabelecer estratégias para a prevenção deste tipo de câncer.
É o teste mais utilizado, apesar de suas limitações, uma vez que somente as porções posterior e lateral da próstata podem ser palpadas, deixando de 40% a 50% dos tumores fora do seu alcance. As estimativas de sensibilidade variam entre 55% a 68%. O valor preditivo é estimado entre 25% e 28%. Quando utilizado em associação à dosagem do PSA com valores entre
Antígeno prostático específico (PSA) é uma substância produzida pelas células da glândula prostática. O PSA é encontrado principalmente no sêmen, mas uma pequena quantidade é também encontrada no sangue. A maioria dos homens saudáveis têm níveis menores de 4 ng/ml de sangue. A chance de um homem desenvolver câncer de próstata aumenta proporcionalmente com o aumento do nível do PSA.
Geralmente quando o câncer de próstata está presente o nível do PSA está acima de 4 ng/ml. Entretanto, um nível abaixo desse valor não significa que o câncer não esteja presente. Quase 15% dos homens com PSA abaixo de 4 ng/ml são diagnosticados com câncer de próstata na biópsia. Os homens com nível de PSA na faixa de 4 ng/ml e 10 ng/ml, têm uma chance de 1 em 4 de ter a doença. Se o PSA se encontra acima de 10 ng/ml, a possibilidade de ter câncer de próstata é superior a 50%.
Se o nível do PSA de um paciente é elevado, o médico pode sugerir a repetição do exame após um determinado intervalo de tempo ou a realização de uma biópsia da próstata para fechar o diagnóstico. Nem todos os médicos concordam com o mesmo ponto de corte do PSA para sugerir uma biópsia, alguns sugerem a realização de biopsia se o PSA é ≥ 4, enquanto outros podem recomendá-la a partir de ≥ 2,5. Outros fatores, como idade, raça e histórico familiar do paciente, também são considerados.
Surgiu como teste promissor na detecção precoce do câncer da próstata, porém a relação custo-benefício deve ser cuidadosamente avaliada. A primeira dificuldade na avaliação da sensibilidade e especificidade do teste é a falta de consenso sobre o ponto de corre ideal e clinicamente significativo, com autores propondo valores que vão de 3 a 10 ng/ml.
Considerando um ponto de corte em 4,0 ng/ml, a sensibilidade estimada varia de 35% a 71% e a especificidade de 63% a 91%. Estudos que estimaram seu valor preditivo positivo apontam para valores em torno de 28%, o que significa que cerca de 72% dos pacientes com dosagem do PSA alterada são submetidos a biópsias desnecessárias.
Como o antígeno dosado é produzido pelas células epiteliais da próstata e não especificamente pela célula cancerosa, a dosagem do PSA pode estar alterada por outras doenças que não o câncer, como a prostatite e a hiperplasia benigna da próstata, assim como após a ejaculação e a realização de uma cistoscopia.
A forma mais aceita atualmente de rastreamento do câncer de próstata é a associação entre o toque retal e a dosagem sérica do PSA.
Dessa forma, a chance do indivíduo com toque retal alterado ter câncer de próstata é aumentado de acordo com o valor do PSA.
O exame clínico de toque retal ou toque digital da próstata gera polêmica por motivos culturais que interferem diretamente na decisão de realizar o exame/diagnóstico; são criadas barreiras por grande parte dos homens, uma vez que o método do toque pode ser visto como uma violação ou um comprometimento da masculinidade.
No campo da prevenção da doença e da elaboração de políticas de assistência à saúde do homem se faz necessário maior investimento em campanhas para que estas questões sejam suficientemente debatidas.
No momento, não existem evidências concretas de que o rastreamento para o câncer de próstata identifique homens que precisem de tratamento ou de que esta prática reduza a mortalidade pela doença.
O rastreamento do câncer de próstata como qualquer intervenção em saúde, pode trazer benefícios e malefícios/riscos que devem ser analisados e comparados antes da incorporação na prática clínica e como programa de saúde pública. O benefício esperado é a redução na mortalidade pelo câncer de próstata.
Os possíveis malefícios incluem resultados falso-positivos, infecções e sangramentos resultantes de biópsias, ansiedade associada ao sobre diagnóstico de câncer e danos resultantes do sobre tratamento de cânceres que nunca iriam evoluir clinicamente.
Indivíduos sintomáticos devem ser imediatamente encaminhados à consulta especializada em centos de referência para realização dos procedimentos diagnósticos necessários.
Para homens assintomáticos com idade entre 50 e 70 anos não está indicado o rastreamento populacional, baseado na ausência de evidencias cientificas de que as estratégias atualmente disponíveis (toque retal e dosagem de PSA) reduzam a mortalidade por este câncer, além do risco de seus efeitos adversos.
Quando houver risco aumentado para o desenvolvimento de câncer da próstata (história de pai ou irmão com diagnóstico de câncer da próstata antes dos 60 anos) deve-se proceder o encaminhamento para consulta especializada em centros de referência para aconselhamento apropriado, que inclui orientação sobre as limitações, os benefícios e os riscos do rastreamento do câncer da próstata.
REFERENCIAS BIBLIOGRÁFICAS
6. Reconhecer a herança genética envolvida neste tipo de tumor.
O câncer de próstata é uma doença extremamente heterogênea com múltiplos loci contribuindo para sua susceptibilidade. A forma hereditária pode explicar a grande proporção dessa doença entre os homens jovens, ocorrendo em 10% a 20% dos casos do câncer de próstata.
No Brasil, foi o responsável pela segunda maior taxa de mortalidade por neoplasia em homens no período entre 2002 e 2004, com 10,31 mortes por 100 mil homens.
Os loci do câncer de próstata foram mapeados nos cromossomos 1q24-25, 1q42, Xq27-28, 1p36 e 20q13. Vários genes mutados estão sendo encontrados no câncer de próstata, tais como: TP53, PTEN, RB ras, CDKN2, AR (receptor de andrógenos) e CTNNB1. A mutação de ponto mais comum foi observada em TP53 e é característica de doenças em estágios avançados.
Os genes MSH2 e PMS2 têm sido encontrados com mutação na linhagem celular do câncer de próstata e foi determinado a partir do estudo de famílias com câncer de próstata, com indivíduos acometidos em idade inferior a 66 anos e uma história familiar confirmada de câncer de cérebro primário.
Testes genéticos preventivos serão vitais para a estratégia de prevenção desse tipo de câncer, os quais incluem: mudanças dietéticas, uso de suplementos nutricionais ou de agentes químico-preventivos para alterar a história natural de homens com alto risco de desenvolver câncer de próstata.
A utilização do antígeno prostático específico (APE) muito tem contribuído para o diagnóstico precoce de câncer de próstata, proporcionando um melhor prognóstico para o paciente. O aconselhamento genético pode ser utilizado como uma ação de saúde pública para reduzir a morbidade e mortalidade de homens com risco aumentado para câncer de próstata.
Visto pela genética, o câncer de próstata pode ser classificado em três grupos:
- Hereditário, que é condicionado por um gene com transmissão mendeliana.
- Familiar, quando não se descobre o gene envolvido ou os portadores da doença não possuem os requisitos da hereditariedade, embora, na família, seja possível observar casos.
- Esporádico, quando se observam casos isolados nas famílias do paciente.
A transmissão do Câncer de Próstata Hereditário é responsável por um gene autossômico dominante. Foram descobertos dois genes: o HPC-1, ou gene do câncer de próstata hereditário – 1; e o HPC-2, ou gene do câncer de próstata hereditário – 2.
O referido autor ainda cita que o HPC-1 é um gene raro e sua frequência genética varia nas populações em que o gene foi estudado. Tal gene é responsável por 10% das neoplasias prostáticas de um modo geral e por 45% das neoplasias que ocorrem antes dos 55 anos de idade. Provavelmente outros dois genes estão envolvidos com a susceptibilidade hereditária a doença, o RNASEL e o MSR1, que estão relacionados a sínteses de proteínas.
Outros genes possivelmente envolvidos com a câncer prostático são NKX3.1, PTEN e AR. O polimorfismo dos genes AR, CYP17 e SRD5A2, influenciaram também no desenvolvimento e progressão do câncer de próstata e podem estar envolvidos na variação de risco associada à etnia.
Os afrodescendentes estadunidenses e jamaicanos possuem uma incidência maior da doença no mundo, em relação à população de etnias semelhantes de outras partes do mundo. Seabra (1998) verificou o fato de que se um gêmeo monozigótico (idêntico) tem a neoplasia, o risco de seu irmão também desenvolver a doença é de 27%, enquanto entre gêmeos dizigóticos (não idênticos) esse risco é de apenas 7%.
O mesmo autor afirma que três condições chamam a atenção para a presença da doença na família: três ou mais homens com a doença, a presença de pelo menos um homem com a doença em três gerações sucessivas (linhagem paterna ou materna), e a presença de dois ou mais homens em uma mesma geração, cujo tumor foi diagnosticado antes dos 55 anos.
A literatura discute que a alimentação, uso do tabaco, álcool e a obesidade não tem influenciado para o desenvolvimento do câncer de próstata sendo assim o fator hereditário a sua maior causa. Portanto merecem mais estudos os fatores que levam o desenvolvimento deste tipo de câncer. A divisão do câncer de próstata em hereditário, familiar e esporádico não é apenas didática.
As famílias em que o gene pode estar presente devem ser orientadas. Os homens dessas famílias devem procurar o urologista mais precocemente em torno dos 45 anos de idade, a fim de serem submetidos ao toque retal e à dosagem do PSA sérico. Tais pacientes devem anualmente fazer uma prevenção, uma vez que as medidas ajudam a reduzir a mortalidade decorrente do câncer de próstata, pois, nos homens que apresentam predisposição hereditária para a doença, esta ocorre com maior frequência e mais precocemente, caracterizando-se por um comportamento biológico mais agressivo.
REFERÊNCIA BIBLIOGRÁFICA
7. Explicar o significado clínico da escala de Gleason na avaliação do tumor de próstata.
O diagnóstico de certeza do câncer da próstata é feito pelo estudo histopatológico do tecido obtido pela biópsia da próstata, que deve ser considerada sempre que houver anormalidades no toque retal ou na dosagem do PSA.
O relatório anatomopatológico deve fornecer a graduação histológica do sistema de Gleason, cujo objetivo é informar sobre a provável taxa de crescimento do tumor e sua tendência à disseminação, além de ajudar na determinação do melhor tratamento para o paciente.
Na graduação histológica, as células do câncer são comparadas às células prostáticas normais. Quanto mais diferentes das células normais forem as células do câncer, mais agressivo será o tumor e mais rápida será sua disseminação.
A escala de graduação do câncer da próstata varia de 1 a 5, com o grau 1 sendo a forma menos agressiva:
- Grau 1: As células são, geralmente, uniformes e pequenas e formam glândulas regulares, com pouca variação de tamanho e forma, com bordos bem definidos, densamente agrupadas, distribuídas homogeneamente e com muito pouco estroma entre si.
- Grau 2: As células variam mais em tamanho e forma e as glândulas, ainda uniformes, mostram-se frouxamente agrupadas e com bordos irregulares.
- Grau 3: As células variam ainda mais em tamanho e forma, constituindo glândulas muito pequenas, uniformes, anguladas ou alongadas, individualizadas e anarquicamente espalhadas pelo estroma. Podem formar também massas fusiformes ou papilíferas, com bordas lisas.
- Grau 4: Muitas das células estão fusionadas em grandes massas amorfas ou formando glândulas irregulares, que são distribuídas anarquicamente, exibindo infiltração irregular e invadindo os tecidos adjacentes. As glândulas podem apresentar, ainda, células pálidas e grandes, com padrão hipernefróide.
- Grau 5: Tumor anaplásico. A maioria das células estão agrupadas em grandes massas que invadem os órgãos e tecidos vizinhos. As massas de células podem exibir necrose central, com padrão de comedocarcinoma. Muitas vezes, a diferenciação glandular pode não existir: padrão de crescimento infiltrativo tipo cordonal ou de células soltas.Obtenção do Escore
Para se obter o escore total da classificação de Gleason, que varia de 2 a 10, o patologista gradua de 1 a 5 as duas áreas mais frequentes do tumor e soma os resultados. Quanto mais baixo é o escore de Gleason, melhor será o prognóstico do paciente.
Escores entre 2 e 4 significam que o câncer provavelmente terá um crescimento lento. Escores intermediários, entre 5 e 7, podem significar um câncer de crescimento lento ou rápido e este crescimento vai depender de uma série de outros fatores, incluindo o tempo durante o qual o paciente tem o câncer.
Escores do final da escala, entre 8 e 10, significam um câncer de crescimento muito rápido.
- Gleason de 2 a 4 – existe cerca de 25% de chance de o câncer disseminar-se para fora da próstata em 10 anos, com dano em outros órgãos, afetando a sobrevida.
- Gleason de 5 a 7 – existe cerca de 50% de chance de o câncer disseminar-se para fora da próstata em 10 anos, com dano em outros órgãos, afetando a sobrevida.
- Gleason de 8 a 10 – existe cerca de 75% de chance de o câncer disseminar-se para fora da próstata em 10 anos, com dano em outros órgãos, afetando a sobrevida.
REFERÊNCIA BIBLIOGRÁFICA
8. Citar as possibilidades terapêuticas do câncer de próstata.
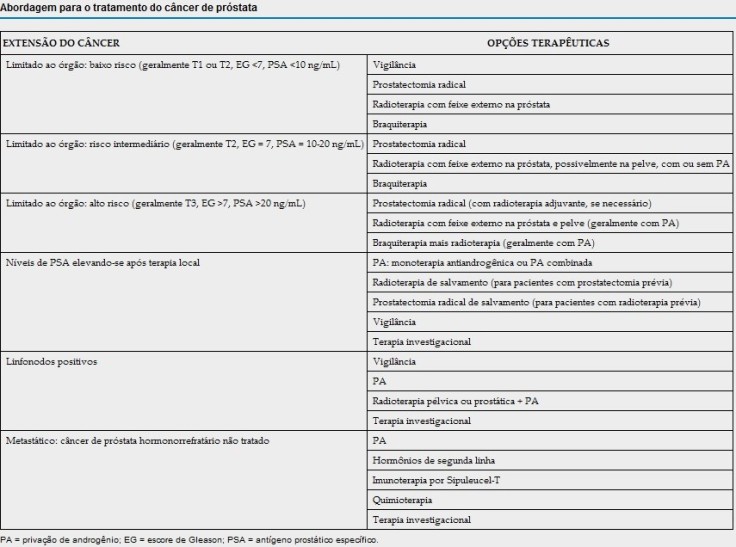
Bibliografia: GOLDMAN L., AUSIELLO D. Cecil: Medicina. 23ª ed. Rio de Janeiro: Elsevier, 2009. Vol I e II.
9. Caracterizar o estadiamento do câncer de próstata.
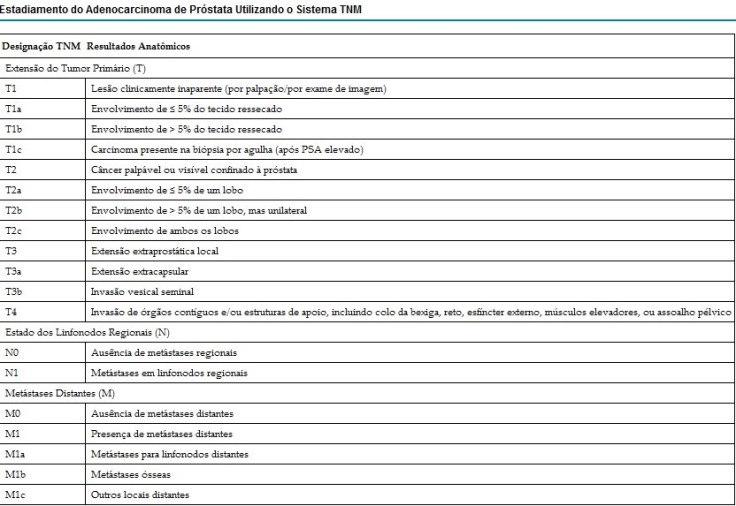
Conhecer o estágio ajuda a definir o prognóstico e é útil para se escolher a terapia. O sistema mais comum é o sistema de quatro estágios, o sistema TNM (abreviação para Tumor/Linfonodos/Metástases). Seus componentes incluem o tamanho do tumor, o número de linfonodos envolvidos e a presença de alguma metástase. A distinção mais importante feita pelo estadiamento é se o câncer está ou não ainda confinado à próstata. No sistema TNM, os cânceres T1 e T2 são encontrados somente na próstata, ao passo que os T3 e T4 já se espalharam.
O estadiamento do câncer prostático também é importante para a seleção da forma de terapia. O estágio T1 se refere ao câncer encontrado incidentalmente. O estágio T2 corresponde ao câncer confinado ao órgão. Os tumores em estágio T3a e T3b exibem extensão extraprostática, com e sem invasão da vesícula seminal, respectivamente. O estágio T4 reflete invasão direta dos órgãos contíguos. Qualquer disseminação do tumor para linfonodos, independentemente da extensão, eventualmente é associada a uma evolução fatal, de modo que o sistema de estadiamento simplesmente registra a presença ou ausência deste achado (N0/N1).
Referência Bibliográfica: ROBBINS & COTRAN. Patologia: Bases patológicas das doenças. 8ª Edição. Rio de Janeiro: Elsevier, 2016. 1458 p.





Comentários