Questões
- Descrever as adaptações fisiológicas da gravidez.
- Caracterizar as manifestações clínicas em cada trimestre da gravidez.
- Descrever o pré-natal de acordo com as orientações do Ministério da Saúde, sua importância e periodicidade.
- Relacionar as medidas obstétricas realizadas clinicamente com a avaliação do crescimento e vitalidade fetal. Falar do ácido fólico e do uso de vitaminas.
- Discutir políticas públicas referentes à gravidez.
Respostas
-
Descrever as adaptações fisiológicas da gravidez.
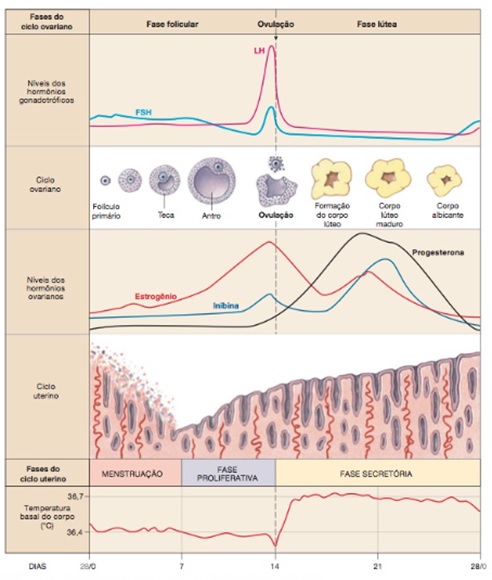
ALTERAÇÕES METABÓLICAS
Até 24 a 26 semanas, o organismo materno experimenta uma fase de anabolismo materno, direcionando o aporte energético para as reservas maternas; daí em diante, inicia-se uma fase catabólica da gestação aumentando o aporte energético para o feto.
- Metabolismo da glicose, carboidratos e lipídios
Na fase anabólica, observa-se aumento na lipogênese, na glicogênese hepática e na transferência de glicose para o feto; isso causa uma redução na glicemia basal e de jejum.
Na fase catabólica, o metabolismo glicêmico tem como objetivo suprir o feto com glicose e aminoácidos, enquanto utiliza ácidos graxos livres e cetonas como substrato materno. O hormônio lactogênico placentário e a prolactina causam aumento no número de células beta pancreáticas. A gravidez normal leva a um a um aumento na secreção de insulina e, no início, a um aumento na sensibilidade à insulina.
Com o passar da gestação e o aumento de ácidos graxos livres circulantes derivados da estimulação do mecanismo de lipólise, ocorre aumento na resistência insulínica. Essas mudanças podem explicar o aumento fisiológico do colesterol e triglicérides durante a gestação.
Existe aumento da retenção proteica, com acumulo de até 1000g de proteína ao final da gestação. É observado aumento da albumina total e redução de sua fração plasmática. Proteínas como fibrinogênio e alfa e betaglobulinas também apresentam níveis aumentados.
SISTEMA DIGESTÓRIO
As alterações nesse sistema são diversas e mudanças nas preferencias alimentares são bem comuns.
A gengiva é a principal afetada. O aumento e ingurgitamento da papila interdigital da gengiva podem causar sangramento gengival, úlceras e dor. Essas mudanças incluem os hormônios gestacionais e alterações vasculares e inflamatórias.
Pode ocorrer o granuloma gravídico que é a lesão benigna da gengiva, caracterizado por pequenas manchas rosas ou avermelhadas, lisas ou lobuladas. Também pode ocorrer a sialorreia que tem sua causa relacionada com o refluxo gastroesofágico, náuseas, vômitos gestacionais, algumas medicações. A sialorreia é a secreção salivar exacerbada.
A alteração e reclamação mais comum é a pirose (queimação) e é encontrado em até 80% das gestantes; tem como principal causa o refluxo gastroesofágico. É decorrente da diminuição do tônus do esfíncter esofágico inferior, do menor peristaltismo gastrointestinal e do maior tempo de esvaziamento gástrico decorrentes das altas taxas de progesterona e do aumento da pressão intra-abdominal pelo útero gravídico. A progesterona promove relaxamento de toda a musculatura lisa e diminuição da concentração plasmática de motilina.
A topografia é alterada, sendo deslocado superior e posteriormente até adquirir a posição dorsoventral. Além de ter o seu tempo de esvaziamento aumentado. Funcionalmente, a produção de ácido gástrico está diminuída nos dois primeiros trimestres e aumentada no terceiro trimestre.
O fígado é empurrado em direção ao tórax, pois há deslocamento cranial do diafragma. Também ocorre abertura do ângulo costofrênico. É comum estar palpável no exame físico. A função hepática continua a mesma, apenas o transporte de sais biliares que se apresenta parcialmente inibido – é um efeito secundário da ação do estrógeno e progesterona.
As dosagens de colesterol total e de triglicerídeos aumentam durante a gravidez, porém, em níveis discretos. A concentração sérica de fosfatase alcalina apresenta-se significativamente maior que o normal no terceiro trimestre, sendo justificada pelo aumento de produção dessa substancia pela placenta.
A dosagem de gamaglobulina sofre redução significativa. As taxas de aminotransferases, bilirrubina e ácidos biliares devem permanecer normais.
A motilidade é reduzida, o seu volume em jejum e o volume residual após a contração da vesícula pode estar aumentados, porém, não ocorre mudança no tamanho do ducto hepático comum.
Os níveis séricos de amilase permanecem normais ou sofrem aumento discreto.
É muito comum que as mulheres se sintam constipadas durante a gestação; é referido por 30% das grávidas. A constipação provavelmente é causada pela distensão abdominal e pelas mudanças hormonais que afetam a motilidade colônica e o intestino delgado.
O aumento da progesterona é o maior responsável pela redução da contratilidade intestinal. Também há quedas nas taxas de motilina – hormônio estimulante gastrointestinal, causada pelo aumento da progesterona que reduz a sua liberação.
Como resultado da diminuição da motilidade e do aumento da absorção de água e sódio, as fezes podem sofrer desidratação excessiva. Tais modificações tem papel importante na piora dos sintomas dos mamilos hemorroidários.
SISTEMA RENAL E URINÁRIO
Ocorre uma elevação do fluxo plasmático glomerular causado pelo aumento da volemia associado à redução da resistência vascular periférica. Devido ao aumento do fluxo, ocorre também uma aceleração do ritmo de filtração glomerular. Essas modificações ocorrem a partir da décima semana e sofrem redução discreta antes do termo da gestação.
A osmolaridade plasmática se modifica na gravidez. Ocorre filtração de maiores quantidades de sódio e água no glomérulo, que são compensadas por maior reabsorção tubular desses elementos, resultante da ação da aldosterona e da arginina-vasopressina.
Devido à influência da posição materna no fluxo plasmático glomerular e no ritmo de filtração glomerular, observa-se depuração renal até 20% menor em posição supina que em decúbito lateral. O padrão de excreção urinária é maior à noite, em razão do repouso em decúbito, com maior mobilização dos fluidos extravasculares e menor capacidade de reabsorção de água livre.
A gestação promove aumento das concentrações de óxido nítrico, endotelina e relaxina. Esta, produzida pelo corpo lúteo, age na osmolaridade plasmática, aumentando o ritmo de filtração glomerular. A endotelina, apesar de ter potente ação vasoconstritora, age como estabilizadora do tônus vascular nos vasos renais.
A progesterona provoca hipotonia da musculatura dos ureteres e da bexiga, causando discreta hidronefrose e aumento do volume residual vesical. Fatores mecânicos, como aumento do plexo vascular ovariano direito, rotação do útero para a direita e compressão extrínseca uterina, predispõem à acentuação da hidronefrose do lado direito e redução da capacidade vesical.
A bexiga encontra-se mais elevada ao longo da gestação, com retificação do trígono vesical, provocando refluxo vesicoureteral. Incontinência urinária é queixa comum. Durante o trabalho de parto, a compressão da apresentação fetal sobre a bexiga acarreta edema e microtraumas na mucosa, aumentando as chances de hematúria e infecção. Tais transformações aumentam o risco de formação de cálculos e de infecções do trato urinário.
PELE E ANEXOS
Ocorre uma hipervascularização e hiperpigmentação. Os níveis elevados de estrogênios levam à proliferação de vasos em todos o tegumento (angiogênese), e a produção de progesterona leva a vasodilatação.
Comumente observamos: nevo aracnoide, eritema palmar, aumento da sudorese, aumento da secreção sebácea e hipertricose. Existe tendência ao aumento da oleosidade da pele, em especial no primeiro trimestre, podendo ser observadas manifestações acneicas. Pode haver aumento da pilificação facial, e, eventualmente, no tronco e membros. Esse fenômeno reverte espontaneamente após o parto; nessa época, frequentemente, ocorre aumento da queda de cabelos, em graus variáveis, com retomada do padrão normal de 6 a 12 meses após o final da gravidez.
A hiperpigmentação está relacionada ao estímulo que a progesterona exerce sobre a secreção do hormônio melanotrófico pela hipófise. Esse hormônio, por sua vez, age sobre as moléculas de tirosina na pele, induzindo à produção de melanina. O aumento da produção de melanina determina o aparecimento de hiperpigmentação em áreas específicas: face e fronte (melasmas ou cloasmas gravídicos), linha nigra (projeção cutânea da linha alba), aréola mamária com surgimento de aréola secundária (sinal de Hunter) e regiões de dobras. Essa hiperpigmentação pode piorar com a exposição solar e tende a desaparecer algumas semanas após o final da gestação. As estrias são comuns, tanto pelo aumento da distensão da pele como pelo aumento da produção de cortisol.
TRATO REPRODUTOR
Os ovários abrigam o corpo lúteo gravídico até por volta da 12a semana de gestação, sendo este o responsável pela produção progestagênica até que o trofoblasto devidamente implantado seja capaz de assumir tal produção. O crescimento e a manutenção do corpo lúteo gravídico se dão por estímulo dos altos níveis de hCG produzidos pelo trofoblasto. Após o final do primeiro trimestre, com a estabilização e a redução dos níveis de hCG, observa-se a involução desse corpo lúteo.
Existe um aumento significativo da rede vascular arterial e venosa ovariana em número e calibre dos vasos. Os pedículos ovarianos contribuem com até 30% do suprimento sanguíneo do útero na gravidez. Outras modificações são observadas nos ovários.
Devido à ação da hCG circulante, pode ocorrer estimulação folicular, com aparecimento de cistos múltiplos e bilaterais (chamados de cistos tecaluteínicos) que regridem completamente ao fim do puerpério. Podem, ainda, ser encontrados focos de reação decidual esparsos em ambos os ovários.
Inicialmente, elas são perpendiculares, mas, na gestação elas se estiram, tornando-se paralelas ao útero. A vascularização intensa e reação decidual irregular modifica a aparência da tuba, em especial das fimbrias.
Os ligamentos largos, redondo e paramétrios ficam edemaciados e se tornam congestos.
A coloração uterina passa a ser violácea, devido ao aumento da vascularização e da vasodilatação venosa. A retenção hídrica do espaço extravascular torna a consistência do útero amolecida. As alterações de volume e peso são marcantes, e um útero não gravídico tem aproximadamente 60 a 70 g de peso e 10 ml de capacidade, podendo atingir 700 a 1.200 g e 5 l de capacidade ao final da gestação.
Até a 12a semana de gestação, o útero está intrapélvico, assimétrico, com aumento do corno onde se encontra implantado o embrião (sinal de Piskacek). Com o crescimento do útero e até por volta de 20 semanas, ele se torna esférico e passa a ocupar também a região abdominal, desviando-se para o lado direito. A dextrorrotação pode levar à compressão do ureter ipsilateral, com estase urinária.
Com o progredir do peso do órgão sobre a vagina, o útero ocupa os fórnices vaginais laterais, traduzindo o sinal de Noble-Budin. Para melhor suprimento sanguíneo das fibras musculares, com o crescimento do útero, ele transforma sua forma esférica em cilíndrica com o alongamento dessas fibras, fenômeno também conhecido como conversão uterina.
As fibras miometriais sofrem hiperplasia, hipertrofia e alongamento, sendo a hipertrofia o fenômeno mais pronunciado e podendo ocorrer um aumento de até 10 vezes o diâmetro da fibra muscular.
Ocorre aumento significativo da irrigação uterina, provido pelas artérias uterinas (ramos das artérias ilíacas internas) e pelas artérias ovarianas (ramos diretos da aorta), sendo que o aporte sanguíneo do útero representa cerca de 3 a 6% do débito cardíaco no início da gestação, chegando até 12% no final dela. As alterações vasculares observadas no território uteroplacentário sofrem influência das alterações hormonais, com aumento da vasogênese e da vasodilatação, e também das alterações decorrentes das ondas de invasão trofoblástica, com remodelamento vascular e queda da resistência no leito placentário.
O endométrio sofre modificações celulares em toda a sua extensão, com formação da decídua basal (onde se implanta o embrião), da decídua reflexa (que envolve o saco gestacional) e da decídua parietal (que reveste a porção do útero onde não houve a implantação); as decíduas parietal e reflexa se fundem ao redor da 16a semana de gestação, quando o feto ocupa toda a cavidade uterina.
O istmo, região compreendida entre o corpo uterino e a cérvix, torna-se edemaciado e amolecido, o que corrobora para um aumento da anteversoflexão uterina (sinal de Hegar) no primeiro trimestre e consequente polaciúria por compressão vesical. Na gestação, o istmo alonga-se e incorpora-se ao corpo uterino até a 16a semana de gestação, sendo então chamado de segmento inferior.
O colo do útero edemacia-se e amolece progressivamente, mudando sua consistência – inicialmente similar àda cartilagem nasal para algo parecido com a cartilagem labial (regra de Goodell). Além disso, com as alterações hormonais progressivas da gestação, é comum observarmos a eversão do epitélio colunar da endocérvix, bem como sua metaplasia pela exposição ao conteúdo vaginal, geralmente mais ácido. Ocorre ainda hipertrofia glandular da endocérvix, com maior produção de muco e maior viscosidade, dando origem ao tampão mucoso, ou rolha de Schröeder.
Na vagina, o aumento da vascularização leva a hiperemia e edema da mucosa vaginal, tornando-a arroxeada (sinal de Kluge). Pelo aumento do calibre das artérias vaginais, é possível palpar sua pulsação e paredes laterais vaginais, configurando o sinal de Osiander.
Pelo aumento do edema e hipertrofia das células musculares, observa-se diminuição do pregueamento da mucosa vaginal, aumentando sua elasticidade e plasticidade para a formação do canal de parto ao termo. Com a produção crescente de progesterona, ocorre um acúmulo de glicogênio e consequente proliferação de Lactobacillus, que, por sua vez, produzirão mais ácido lático e causarão diminuição do pH vaginal (3,5 a 6,0), fundamental no controle de infecções bacterianas, porém predispondo a gestante a mais infecções fúngicas.
Na vulva, existe aumento significativo da vascularização local, fazendo surgir varizes vulvares em algumas pacientes. A coloração, pelo mesmo motivo, também se apresenta arroxeada, configurando o sinal de Jacquemier-Chadwick. Ocorre retenção de líquidos e consequente edema do vestíbulo vaginal.
MAMAS
As ações estrogênicas e progestagênica, associadas à produção de prolactina hipofisária, promovem o crescimento e o desenvolvimento mamário, através de hiperplasia e diferenciação celular. Já no início da gravidez são comuns as queixas de mastalgia e/ou sensibilidade mamária; o aumento do volume acentua essas queixas, já a partir da 6a semana. Esses sintomas habitualmente diminuem com o progredir da gestação.
Ocorre aumento do mamilo e de sua pigmentação. A papila torna-se mais saliente e erétil. Comumente, observa-se hiperpigmentação areolar com aparecimento de aréola secundária (sinal de Hunter), bem como aumento da vascularização do órgão, sendo visíveis esses vasos através da pele (rede venosa de Haller). Ocorre aumento das glândulas sebáceas dos mamilos (os chamados tubérculos de Montgomery). Após a 20a semana de gestação, é possível visualizar a saída de colostro após a expressão do mamilo.
A produção e a secreção de colostro após o parto se dá por desbloqueio dos receptores de prolactina, após a dequitação e a queda dos níveis de progesterona e estrogênio. Progressivamente, ocorre transição do colostro para leite maduro, e a manutenção da produção e a secreção láctea se dão por mecanismo neuroendócrino, mediado por prolactina e ocitocina.
SISTEMA CARDIOVASCULAR
No início da gravidez ocorre vasodilatação periférica devido ao aumento do oxido nítrico (NO), fator vasoativo, elaborado pelo endotélio vascular. O acréscimo da frequência cardíaca pode ser visto na 5° semana de gestação o que contribui para elevação do debito cardíaco (DC = volume sistólico + frequência cardíaca). A elevação progressiva na FC prossegue até o 3° trimestre geralmente é de 10-15 bpm, com aumento do DC em média de 5l/min para 7l/min em 20 semanas.
O volume plasmático materno aumenta em até 10% já no início da gravidez (entre a 6a e a 7a semana) e continua a elevar-se até o terceiro trimestre, aumentando de 30 a 50% acima dos valores pré-gravídicos ao redor da 32a semana e permanecendo estável até o final da gravidez.
O papel da hipervolemia no organismo materno está associado ao aumento das necessidades de suprimento sanguíneo nos órgãos genitais, em especial em território uterino. Exerce, ainda, função protetora para a gestante e o feto em relação à redução do retorno venoso (observada nas posições supina e ereta, na segunda metade da gravidez) e às perdas sanguíneas esperadas durante o parto.
Durante o 2°/3° trimestre o útero impede o retorno venoso do coração quando a gravida assume a posição se supina (síndrome de hipotensão supina), pois, o útero realiza uma compressão na veia cava inferior e nas veias pélvicas, gerando aprisionamento de sangue nas pernas e coxas, exibindo edema MMII, tendência a hipotensão lipotimia ortostática, varicosidades, hemorroidas e até perda de consciência, adotando o decúbito lateral esquerdo, posição em que o DC é restaurado quase automaticamente. A compressão da veia cava inferior pelo útero grávido, em especial na posição supina, pode levar à redução da pré-carga e quedas abruptas da pressão arterial e bradicardia por reflexo vagal, chegando à lipotimia (síndrome da hipotensão supina). Durante o trabalho de parto, a pressão arterial eleva-se, devido ao aumento do débito cardíaco durante as contrações e também pela ação de catecolaminas liberadas devido à dor.
As gravidas exibem redução na pressão arterial devido ao decréscimo da resistência vascular periférica. A diminuição da pressão diastólica é mais acentuada (10-15 mmHg) do que a sistólica (5-10 mmHg). Assim, no início da gravidez há aumento da pressão de pulso e mais tarde se equipara àquela encontrada fora da gravidez. A aferição precisa da pressão diastólica é fundamental para caracterizar o estado hipertensivo na gravidez.
Durante o parto: cada contração uterina leva a autotransfusão de 300-500 ml de sangue de volta para o sistema circulatório. O DC aumenta 34% durante as contrações e 12% nos intervalos. A resposta simpática a dor e à ansiedade causa maior elevação na FC e na pressão sanguínea.
Pós-parto imediato: útero contraindo firmemente, autotransfusão sanguínea (300 ml), aumentando DC (60-80%), seguindo pelo rápido declínio para valores anteriores ao parto em 1 hora. Em 6-8 semanas o DC reassume seus valores não gravídicos.
- Renina, angiotensina II e volume plasmático
O sistema renina-angiotensina-aldosterona tem sua atividade aumentada de forma a suplantar a ação de mecanismos excretores, sofrendo aumento da filtração glomerular e do peptídeo atrial natriurético. Fora do ciclo gravídico-puerperal, elevações agudas da volemia ativam receptores de volume e barorreceptores presentes nos átrios e em grandes vasos, assim como a baixa osmolaridade plasmática provoca a excitação de quimiorreceptores do hipotálamo anterior. Esses estímulos acarretam secreção de peptídeo atrial natriurético, que atua em receptores presentes em rins, adrenais e vasos, acarretando excreção de sódio e água, e vasodilatação. Durante a gravidez, apesar do aumento progressivo dos níveis séricos de peptídeo atrial natriurético, o aumento lento da volemia torna os receptores menos sensíveis aos estímulos, permitindo o acúmulo de sódio e água pelo organismo materno. Ocorre ainda queda da resistência vascular sistêmica, que atinge seu máximo entre a 14a e 24a semanas. Esse fenômeno começa já no início da gravidez, mediado pela progesterona, pela prostaciclina e também pela ação de óxido nítrico. Essas substâncias levam à refratariedade vascular aos estímulos vasoconstritores da angiotensina II e catecolaminas. A vasodilatação aciona os barorreceptores atriais, com estimulação da vasopressina (com retenção de água) e também do sistema renina-angiogensina-aldosterona (levando à retenção de sódio), o que também contribui para o aumento progressivo da volemia. A resistência vascular periférica começa a subir progressivamente após a 22a/24a semanas, voltando aos níveis pré-gravídicos no termo.
O coração sofre alterações de posição, volume e função. O aumento da volemia e débito cardíaco leva à remodelação cardíaca, com hipertrofia dos miócitos e aumento de seu volume como um todo. O aumento do órgão está associado a alterações nas valvas cardíacas – é frequente a observação de refluxo discreto valvar (especialmente em valvas mitral e tricúspide) ao exame clínico e à ecocardiografa. À ausculta, 90% das gestantes apresentam sopro sistólico leve (especialmente em borda esternal e foco mitral), até 20% sopro diastólico leve (em geral, em foco aórtico), e em até 10% pode ser observado sopro contínuo (associado à hipervascularização no local das mamas). A posição cardíaca altera-se progressivamente. A elevação do diafragma faz com que haja desvio para cima e para a esquerda, além de leve rotação anterior. As modificações anatômicas e funcionais devem ser levadas em conta na interpretação de exames – a área cardíaca pode parecer aumentada à radiografa de tórax na segunda metade da gravidez, e à eletrocardiografa são observadas alterações, como o desvio do eixo cardíaco em 15 a 20º para esquerda, além de alterações fisiológicas nas ondas Q, T e no segmento ST.
Alterações vasculares mais relevantes:
- Aumento da frequência cardíaca (10-20%)
- Aumento do volume sistólico (10%)
- Aumento do debito cardíaco (30-50%)
- Diminuição da pressão arterial média (10%)
- Diminuição da resistência periférica (35%)
SISTEMA SANGUÍNEO
Na gravidez ocorre aumento no volume plasmático e consequentemente da volemia materna, causando diluição na maioria dos fatores circulantes, principalmente hemodiluição das hemácias, dessa forma os níveis plasmáticos de contagem de hemácias, hematócrito e concentração de hemoglobina estão reduzidos, mesmo que a concentração de eritrócitos esteja aumentada.
Hemoglobina se reduz de 13,3 g/dl para 11 g/dl, por isso, a mulher gravida requer maior quantidade de ferro alimentar para suprir as suas necessidades e as do concepto e aumento da absorção pelo intestino, sua quantidade é determinada pela ingesta, perda e armazenamento. Concentrações de hemoglobina abaixo de 11,0 g/dL devem ser consideradas anormais, em particular no final da gestação, sendo em geral causadas por deficiência de ferro, e não pela hipervolemia da gravidez.
A hipovolemia induzida pela gravidez tem funções importantes. Primeira, responder às demandas metabólicas do útero aumentado com seu sistema vascular intensamente hipertrofiado. Segunda, prover nutrientes e elementos em abundância para dar suporte ao rápido crescimento da placenta e do feto. O aumento do volume intravascular também protege a mãe e, consequentemente, o feto contra os efeitos deletérios das posições supina e ereta sobre o retorno venoso. Por fim, salvaguardar a gestante contra os efeitos adversos da perda sanguínea associada ao parto.
Estabelece-se, assim, um estado de hemodiluição e, consequentemente, a viscosidade plasmática está diminuída, o que reduz o trabalho cardíaco. Esses processos adaptativos iniciam-se já no primeiro trimestre de gestação, por volta da 6° semana, com expansão mais acelerada no segundo trimestre, para finalmente reduzir sua velocidade e estabilizar seus níveis nas últimas semanas do período gravídico.
A quantidade total de ferro no organismo é determinada pela ingesta, perda e armazenamento. Existem 2,3 g de Fe total no organismo da mulher. 1 g é necessário para uma gestação normal, sendo 300 mg ativamente transferidos ao feto e placenta, 200 mg são perdidos via trato gastrintestinal. O aumento de eritrócitos circulantes (450 ml) requer 500 mg de Fe. Uma série de eventos contribui para essa demanda de ferro: o consumo pela unidade feto placentária, a utilização para produção de hemoglobina e mioglobina resultante do aumento da massa eritrocitária e da musculatura uterina, e a depleção por meio de perdas sanguíneas e do aleitamento. A maior parte do Fe é utilizada durante a metade final da gestação e atingem a média de 6 a 7 mg/dia. Na maioria das gestantes, a necessidade de Fe não é suprida pelas reservas, sem suplementação de ferro não haverá o aumento ideal no volume eritrocitário materno, e a hemoglobina e o hematócrito diminuirão de forma evidente à medida que o volume plasmático aumenta. Ao mesmo tempo, a produção de hemácias pelo feto não é prejudicada porque a placenta transfere ferro mesmo quando a mãe apresenta anemia ferropriva grave. Efeitos adversos do ferro suplementar: refluxo e constipação. No momento do parto vaginal e nos dias seguintes, metade dos eritrócitos adicionados é perdida (500 a 600 ml de sangue), cesariana ou parto vaginal de gêmeos (1 L).
O início da gestação é pró-inflamatório, durante a implantação e a placentação, o blastocisto deve penetrar o revestimento epitelial da cavidade uterina e invadir o tecido endometrial. O trofoblasto substitui o endotélio e a musculatura lisa dos vasos sanguíneos para assegurar suprimento sanguíneo. Atraindo células invasoras, gerando morte celular e células de reparo, caracterizando um ambiente inflamatório, assegurando a retirada de restos celulares e o reparo do endométrio. O meio da gestação é anti-inflamatório, o crescimento e desenvolvimento fetal induzem um esse estado. O parto é caracterizado por influxo de células imunes ao miométrio, caracterizando processo inflamatório.
Ao contrário dos glóbulos vermelhos, os glóbulos brancos têm sua concentração aumentada (leucócitos no 3° trimestre: 9 mil/mm3) e no puerpério imediato (20 mil/mm3), devido ao aumento dos polimorfonucleares e linfócitos CD8. A concentração de plaquetas se encontra diminuída (75-320 mil/mm3), devido a hemodiluição e ao consumo de plaquetas (no leito uteroplacentário) caracterizando uma plaquetopenia gestacional no 3° trimestre com contagem inferior a 100.000 mm3.
Ocorrem alterações importantes na coagulação sanguínea sendo caracterizadas por estado de hipercoagulabilidade, com aumento significante de diversos fatores de coagulação, notadamente do fibrinogênio e redução da atividade fibrinolítica do plasma. As proteínas infamatórias da fase aguda estão aumentadas em todo o período gestacional. A proteína C reativa apresenta níveis plasmáticos mais elevados no momento próximo ao parto. A velocidade de hemossedimentação, por sua vez, eleva-se por causa do aumento de fibrinogênio e globulinas no sangue, perdendo seu valor em investigações diagnósticas na gravidez.
Especula-se que todas essas alterações do mecanismo de coagulação sejam mediadas por processos hormonais, relacionados aos altos níveis de estrógeno e progesterona. Todos os fatores de coagulação estão elevados, com exceção dos fatores XI e XIII. Da mesma forma, observa-se aumento em até 50% do fibrinogênio e dímero D (os valores normais de fibrinogênio estão entre 300 e 600 mg/dL). Ocorre diminuição dos níveis plasmáticos de proteína S e resistência à proteína C ativada. A atividade fibrinolítica está reduzida, provavelmente à custa da elevação de inibidores dos ativadores de plasminogênio.
A contração miometrial é o principal mecanismo de defesa, comprimindo os vasos sanguíneos no leito placentário, imediatamente após há deposito de fibrina na ferida placentária utilizando o fibrinogênio circulante. A desvantagem desse mecanismo de hipercoagulubilidade que impede o sangramento patológico do pós-parto é o aumento do risco de tromboembolismo.
A proteína C ativada, em conjunto com os cofatores proteína S e fator V, atua como um anticoagulante neutralizando os fatores pró-coagulantes Va e VIIIa. Durante a gravidez, a resistência à proteína C ativada aumenta de maneira progressiva, estando relacionada com a redução na proteína S livre e com o aumento no fator VIII, que ocorrem concomitantemente.
A gravidez está associada a acréscimo de 20-200% nos níveis de fibrinogênio e de fatores II, VII, VIII, X e XII. A resultante desses efeitos na coagulação na gravidez é promover a formação, extensão e estabilidade do coágulo.
TRATO RESPIRATÓRIO
O sistema respiratório também passa por modificações anatômicas e funcionais. A demanda de oxigênio aumenta de 20 a 30%. Já no início da gravidez é frequente a sensação de falta de ar, explicada pela ocorrência de discreta hiperventilada, com elevação do volume minuto, que progride até o termo (chegando a aumentar até 50% em relação aos níveis basais). Esse aumento está relacionado ao aumento de até 40% no volume corrente. Tal alteração está relacionada à hemodiluição observada durante a gestação, com queda dos níveis de hemoglobina e frequência respiratória mantida. O aumento do volume corrente estabelece situação de hiperventilação, gerando queda da pressão parcial de dióxido de carbono (pCO2). Essa redução gera gradiente que facilita a excreção do CO2 fetal. A alcalose respiratória e o aumento do pH, compensado por redução do bicarbonato, criam situação favorável à passagem de oxigênio para o feto.
Os centros respiratórios do sistema nervoso central sofrem alteração em sua homeostase, de tal forma que elevações na pCO2 deflagram esforços respiratórios exagerados. Essa alteração está ligada aos níveis crescentes de progesterona ao longo da gestação. A progesterona ainda age diretamente na musculatura lisa dos brônquios e vasos pulmonares, facilitando o fluxo aéreo e também o fluxo sanguíneo, pela queda da resistência vascular. A pressão parcial de oxigênio está aumentada durante a gestação.
Paralelamente ao aumento do volume corrente, ocorre redução da capacidade funcional residual em até 20%, relacionada à elevação do diafragma, com consequentes reduções dos volumes de reserva expiratória e volume residual. A capacidade vital e a capacidade inspiratória não estão alteradas durante a gestação. A elevação do diafragma já é observada no primeiro trimestre, entretanto, o aumento do volume uterino diminui sua capacidade de excursão. Ocorre aumento da circunferência e diâmetro da caixa torácica, com abertura do ângulo costofrênico em até 35 graus.
A sensação de dispneia ocasionada pelas adaptações do sistema respiratório durante a gestação pode ser agravada por certo grau de congestão e edema das mucosas nasais. O volume expiratório forçado (FEV 1) não se altera durante a gravidez, refletindo função estável das grandes vias aéreas nesse período.
Embora a queixa de falta de ar seja frequente, dispneia importante, crescente e relacionada a esforços deve levar o clínico a pesquisar alterações cardiopulmonares.
MODIFICAÇÕES ENDÓCRINAS
As modificações hipotalamohipofisárias afetam a tireoide, a adrenal, as gônadas, o balanço hídrico e a lactação, e influencia no crescimento fetal. O GnRH está aumentado e estimula o crescimento placentário.
O hormônio liberador de tireotrofina (TRH) é secretado pelo hipotálamo e estimula as células tireotróficas da hipófise anterior a liberarem o hormônio tireoestimulante (TSH).
O lobo anterior da hipófise aumenta de tamanho à custa de hiperplasia e hipertrofia, em especial dos lactótrofos, estimulados por estrogênio. A prolactina estimula esse aumento.
Durante o primeiro trimestre, o hormônio do crescimento é secretado predominantemente pela hipófise materna, mas com oito semanas já é possível detectar hormônio do crescimento secretado pela placenta.
O hormônio do crescimento placentário é o principal determinante da resistência à insulina na segunda metade da gestação. E os níveis séricos maternos mantêm correlação positiva com o peso ao nascimento, e negativa com a restrição ao crescimento fetal e a resistência arterial uterina.
O estrogênio, o hormônio liberador de tireotrofina e a serotonina estimulam a secreção de prolactina, cuja principal função é assegurar a lactação. No início da gravidez, atua para iniciar a síntese de DNA e o processo de mitose das células epiteliais glandulares e das células alveolares pré-secretoras, além de aumentar o número de receptores de estrogênios de prolactina nessas células. Finalmente, ela promove a síntese de RNA nas células alveolares, a galactopoiese e a produção de caseína, lactalbumina, lactose e lipídeos.
A redução aguda ou crônica no cálcio plasmático ou a redução aguda no magnésio estimulam a liberação do paratormônio (PTH). Acontece aumento no metabolismo de cálcio, em razão das novas demandas fetais, o que leva a uma diminuição do nível sérico de cálcio total, sem alterações no cálcio iônico. Apesar da redução dos níveis de PTH no início da gestação, que vem a ser o estimulador normal para a produção ativa de vitamina D nos rins.
Aumento da tireoide devido a hiperplasia glandular e aumento na vascularidade. Os níveis elevados de TBG (globilina ligadora de tiroxina) aumentam as concentrações séricas totais de tiroxina (T4) e tri-iodotironina (T3), mas não alteram os níveis fisiologicamente importantes de T4 e T3 livres, o feto depende da tiroxina materna, que atravessa a placenta em pequenas quantidades para manter normal a função tireoidiana fetal. Deve-se lembrar que a tireoide fetal só começa a concentrar iodo com 10 a 12 semanas de gestação.
A função tireoidiana está alterada devido à redução dos níveis séricos de iodo, por causa do aumento da taxa de filtração glomerular, glicosilação da globulina transportadora de hormônios tireoidianos e consequente redução nas frações livres dos hormônios e estimulação direta dos receptores de TSH pela β-hCG. Essas alterações podem provocar aumento do volume glandular.
As adrenais não sofrem mudanças morfológicas durante a gestação. A depuração metabólica do cortisol é menor durante a gestação, ocorrendo uma maior resistência em sua metabolização, assim, em resposta aos níveis elevados de progesterona durante a gravidez, haveria necessidade de mais cortisol livre para manter a homeostase.
O sistema renina angiotensina aldosterona é o principal determinante na secreção de aldosterona associado ao ACTH e à hipercalemia. Tal sistema é estimulado durante a gravidez, devido à redução na resistência vascular, na pressão arterial e declínio progressivo da responsividade vascular à aldosterona. O aumento de progesterona sérica de origem placentária faz com que haja uma competição com a aldosterona pelos receptores para mineralocorticoides, tendo, portanto, efeito natriurético. Existe também aumento do cortisol sérico, decorrente da redução de sua excreção e do aumento de sua meia-vida. Os níveis circulantes e excretados de andrógenos adrenais encontram-se reduzidos, possivelmente pelo consumo e pela metabolização em estrogênio placentário.
A produção ovariana de progesterona se dá no corpo lúteo até a 7a semana de gestação a partir da qual a placenta assume sua autonomia hormonal. A produção de andrógenos também está elevada, mas tais substratos são convertidos em estrogênio na placenta, o que não acarreta repercussão fetal.
SISTEMA NERVOSO CENTRAL, VISÃO, OLFATO E AUDIÇÃO
As principais queixas em relação às alterações do SNC são: a sonolência e a diminuição da memória e da concentração. A sonolência já se manifesta no início da gravidez, devendo-se ao aumento dos níveis de progesterona sérica e a alcalose respiratória resultante da hiperventilação.
Alterações vasculares da artéria cerebral média e posterior contribuem para a lentificação geral do SNC, que está associada às alterações de memória e concentração, principalmente no terceiro trimestre. As modificações do padrão de sono contribuem para alterações da concentração e queixas de fadiga frequente. Durante a gestação, diminuem os períodos de apneia do sono, porém ocorre aumento da dispneia na posição supina (dispneia paroxística noturna), no final da gravidez. Essas alterações são maiores com o aumento do volume uterino e do peso corporal, sendo mais intensas em gestações gemelares.
O ciclo grávido-puerperal é permeado por alterações no psiquismo da mulher. Manifestações como hiperemese gravídica, enxaqueca e alguns distúrbios psiquiátricos (hipomania, depressão) podem estar relacionadas a alterações vasculares e hormonais exclusivas da gravidez, por ser um momento único, podem surgir inseguranças e dificuldades psicoafetivas, é dever do obstetra oferecer apoio emocional e identificar as situações nas quais a ajuda profissional deve ser solicitada.
Quanto às modificações oftalmológicas, existe alteração da acuidade visual devido à presença de edema e opacificações pigmentares da córnea. A pressão intraocular está diminuída devido ao aumento da velocidade de reabsorção do humor aquoso.
É comum haver alterações de refração, com mudança de grau de óculos, bem como irritações frequentes causadas pela utilização de lentes de contato, associadas ao edema de córnea.
A mucosa nasal apresenta-se edemaciada e com aumento da vascularização, a exemplo do que ocorre no restante do organismo materno. Assim, epistaxes, rinites vasomotoras e hiposmia são frequentes.
Pode ocorrer diminuição da acuidade auditiva, assim como zumbidos (“tinitus”) e vertigens, principalmente nas gestantes que apresentarem alterações vasculares vestibulococleares mais acentuadas.
SISTEMA MÚSCULO ESQUELÉTICO
As modificações musculoesqueléticas são decorrentes da embebição gravídica, alterações hormonais, como a relaxina secretada pela placenta e das alterações posturais desencadeadas pelo aumento uterino. As articulações, através desses processos adaptativos, preparam o organismo para a parturição – na pelve, as articulações das sinosotoses sacro ilíacas, sacrococcígeas e sínfise púbica se apresentam embebidas e com maior elasticidade, podendo ser observado aumento de até 2 cm na sínfse púbica. Essas alterações aumentam a capacidade pélvica, mas também afetam a postura e a movimentação maternas. A embebição e o relaxamento das articulações, especialmente nos membros inferiores, podem ser responsáveis por dores crônicas e até alterações ortopédicas, como entorses, luxações e até fraturas. A postura é afetada por alterações no eixo da coluna e no centro de gravidade materna, geradas pelo aumento do volume uterino e das mamas; de modo instintivo, a mulher desloca o corpo todo posteriormente, provocando acentuação da lordose e hipercifose da coluna vertebral.
Para compensação, ocorre afastamento dos pés (para ampliação da base de sustentação). Durante a deambulação, o afastamento dos pés e a redução da amplitude os passos levam à alteração motora (“marcha hanserina”). Nesse processo de alterações corpóreas, existe sobrecarga de grupos musculares que não são rotineiramente utilizados. As alterações da posição da coluna podem, ainda, levar à compressão de raízes nervosas, com dores e parestesias nos membros superiores e inferiores, além de lombalgia e fadiga muscular.
Referências Bibliográficas:
- Manual de assistência pré-natal / Sérgio Peixoto. ed. – São Paulo: Federação Brasileira das Associações de Ginecologia e Obstetrícia (FEBRASGO), 2014.
- CUNNINGHAM, F. Gary et al.Obstetrícia de Williams. Porto Alegre: Amgh, 2016.
- REZENDE FILHO, Jorge de; MONTENEGRO, Carlos Antônio Barbosa.Rezende Obstetrícia Fundamental. ed. Rio de Janeiro: Guanabara Koogan, 2011.
- http://www.luzimarteixeira.com.br/wp-content/uploads/2010/08/embebicao-gravidica.pdf
- Williams– 24ª Ed. 2016, Obstetrícia de Williams.
2. Caracterizar as manifestações clínicas em cada trimestre da gravidez.
Os primeiros sinais e os sintomas da gravidez:
- Atraso da menstruação;
- As mamas começam a ficar doloridas e inchadas e há o escurecimento dos mamilos;
- Aumento da frequência urinária;
- Enjoos e vômitos;
- Pequeno sangramento, às vezes, acompanhado por cólicas uterinas;
- Movimento fetal;
- Alterações da pele;
- Cansaço e sonolência.
O tempo de duração de uma gestação é de 40 semanas ou nove meses, podendo chegar no máximo até 42 semanas. Quando a mulher percebe o atraso da menstruação, geralmente está na sexta semana de gestação. Começamos a contar a partir do primeiro dia da sua última menstruação
- 8ª semana: as mamas começam a se desenvolver e se preparam para a amamentação. Há um aumento da vontade de fazer xixi. Até essa fase, o bebê é conhecido como embrião e sua formação acontece primeiro no sentido da cabeça para os pés. Os olhos começam a se formar e o coração já está batendo desde a quarta semana de gestação.
- 12ª semana: a placenta está totalmente formada e é por meio dela que o sangue da mãe passa para o bebê através do cordão umbilical, levando para ele tudo o que necessita para se desenvolver. O bebê já pode chupar o dedo. Tem os músculos funcionando, os genitais estão definidos e os rins já produzem urina.
- 14ª semana: a pele do bebê está mais grossa e forma-se a impressão digital. Na barriga da grávida pode ser percebida uma linha escura (linha nigra), pois a pele ganha mais resistência. Essas mudanças de cor na pele facilitam o aparecimento de manchas, principalmente no rosto. Por isso é importante o uso de protetor solar diariamente durante a gestação. As mulheres que trabalham com computador precisam usar o protetor solar por causa da luz fluorescente, que também pode manchar a pele.
- 16ª semana: as mamas aumentam ao máximo e a aréola fica ainda mais escura para tornar a pele mais resistente. Há também uns pontinhos que fazem a hidratação e a lubrificação natural das mamas, preparando-as para a amamentação. Nessa fase, os genitais do bebê já estão bem visíveis e fica mais fácil identificar o sexo.
- 20ª a 24ª semana: a pele está mais grossa, as sobrancelhas já estão presentes e tem cabelo aparecendo. O bebê já está desenvolvido e os órgãos dos sentidos estão completos. Já pode perceber os estímulos que vem de fora da mãe e sentir. Com aproximadamente 24 semanas, o bebê já pode ouvir, mas não é preciso evitar o barulho porque há uma grande quantidade de sons produzidos no interior do corpo da mãe, fruto do funcionamento dos seus órgãos. O bebê ouve todos esses sons, inclusive os batimentos do coração da mãe. Após o nascimento, ao aproximar o ouvido do bebê do coração da mãe, o nenê consegue identificar os batimentos da mãe e se acalma.
- 28ª semana: o útero aumenta de tamanho e empurra o intestino materno. As atividades do estômago e intestino diminuem, podendo causar intestino preso. O período de sono e vigília (período em que está acordado) do bebê está mais definido. As contrações do útero ficam mais fortes e passam a ser percebidas pela mãe. As gestantes não precisam ficar assustadas quando sentirem essas contrações, pois não significa trabalho de parto prematuro. A placenta produz hormônios que conseguem manter a gravidez. É importante deixar o corpo funcionar adequadamente. A mulher pode estar bastante ansiosa com as exigências próprias dessa fase, no entanto, é importante manter o bem-estar e a tranquilidade.
- 32ª semana: o tamanho do útero começa a dificultar a respiração da mãe, faz aumentar a vontade de fazer xixi e aumenta ainda mais a pressão sobre os vasos sanguíneos. O sistema nervoso já trabalha em conjunto e o bebê consegue movimentar a cabeça. Os sistemas respiratório e digestivo do bebê estão quase funcionando. Os pulmões são os últimos órgãos a se formar. Geralmente, até a 32ª semana o bebê está sentado. Depois, ele muda de posição.
- Entre a 36ª e a 40ª semana pode acontecer o encaixe do feto na bacia da mãe, o que faz com que a barriga dela abaixe.
- Na 37ª semana – O bebê está praticamente maduro e com 40 semanas está completamente preparado para a vida fora do útero.
- Náuseas e vômitos são tão frequentes no início da gravidez que muitas vezes são utilizados como símbolos que expressam a gestação. Ocorrem principalmente no primeiro trimestre. Normalmente, o também chamado “mal-estar matinal”, caracterizado por náuseas, vômitos, indisposição matinal e sialorreia, começa entre a primeira e a segunda semana de atraso menstrual e pode durar até o fim do terceiro mês de gravidez. No entanto, cerca de 20% das mulheres sentem náuseas e vômitos por um longo período de tempo e 2% desse grupo sofrem até o final da gravidez. A teoria é de que são causadas pelo aumento da concentração de gonadotrofina coriônica humana (hCG). Assim, a elevação dos níveis séricos de β-hCG, que ocorre no primeiro trimestre, coincide com o aumento da prevalência de náuseas e vômitos nessa mesma época. O estímulo de β-hCG leva a um aumento dos hormônios tireoidianos (T3 e T4), com predomínio da forma livre do hormônio T4. Essa elevação do T4 livre também pode estar relacionada com a gênese e manutenção de náuseas e vômitos.
- Sialorreia: Algumas gestantes referem aumento da salivação no decorrer do pré-natal. Isso pode estar associado à ingesta de amido, ao estímulo do ramo trigêmeo e à hipertonia vagal. Geralmente, existe um fundo psicológico associado a esse sintoma, por isso, nesses casos, o tratamento psicológico deve ser instituído.
- Pirose: Sintoma causado pelo refluxo gastroesofágico, comum principalmente no final da gravidez, devido à compressão do estômago pelo útero gravídico. Orientações sobre evitar o decúbito horizontal logo após as refeições, assim como fracionar a dieta, evitando a ingestão de alimentos como café, chá, chocolate e frituras, normalmente são suficientes. Nos casos mais graves, a utilização de hidróxido de alumínio ou de magnésio, isolados ou combinados, é indicada.
- Sensação de plenitude: Também é frequente no final da gestação pela compressão do estômago pelo útero gravídico. Orienta-se dieta fracionada com menor volume de alimento em alguns casos, sugerindo a ingestão de substâncias pastosas.
- Constipação: Apresenta-se como queixa comum da gestante durante o pré-natal e deve-se à lentificação do trânsito intestinal, própria desse período. O tratamento consiste desde o aumento da ingestão de líquidos até o uso de laxativos, nos casos mais graves. A suplementação dietética com fibras vegetais ajuda a reduzir a constipação durante a gravidez. Essa suplementação aumenta a frequência de evacuação em 67% das gestantes que a utilizam versus 23% das que não a adotam. Além disso, faz a consistência das fezes ficar mais amolecida. Se não houver resposta à suplementação com fibras, laxativos suaves serão mais efetivos (77%) do que os formadores de volume.
- Hemorroidas: O aumento do volume uterino, que comprime a veia cava inferior e dificulta o retorno venoso, associado à constipação, favorece a dilatação das veias retais, levando ao aparecimento de hemorroidas. O tratamento consiste na prevenção da constipação, uso de anestésicos locais e, nos casos de trombose da veia retal, retirada desta com anestesia local. O tratamento cirúrgico para correção da hemorroida não é indicado durante a gravidez. Deve-se evitar esforço às evacuações.
- Picamalacia: A picamalacia é a perversão alimentar que ocorre em algumas gestantes, caracterizada pelo desejo de ingerir substâncias atípicas. O tratamento consiste em persuadir a gestante dessa prática, mostrando o risco de tal atitude no evoluir normal da gravidez, favorecendo a anemia, interferindo na absorção de nutrientes e facilitando o aparecimento de parasitoses.
- Fraquezas, desmaios, tonturas e vertigens: Esses sintomas aparecem devido à vasodilatação e à hipotonia vascular, comuns na gestação, principalmente no segundo trimestre, pela estase sanguínea nos membros inferiores e pelve e, em algumas situações, pela hipoglicemia em períodos de jejum prolongado. A hipotensão supina que ocorre no terceiro trimestre deve-se à compressão da veia cava inferior pelo útero gravídico. A simples orientação de, nessas ocasiões, manter-se deitada do lado esquerdo até o cessar dos sintomas, além de adotar uma dieta fracionada e manter-se em ambientes arejados costumam ser tratamentos efetivos.
- Varicosidades: Assim como as hemorroidas, as varizes podem aparecer principalmente no final da gravidez e devem-se à dificuldade do retorno venoso imposto pela compressão do útero gravídico à veia cava inferior. Variam desde a sensação de desconforto ao final do dia até casos mais graves, como trombose e tromboflebite. Seu tratamento consiste na orientação de repouso, com os membros superiores elevados e utilização de meias elásticas. Nos casos mais graves, há necessidade de utilização de heparina para promover a anticoagulação. O tratamento cirúrgico não é indicado durante a gravidez.
- Edema: Uma das queixas mais comuns das gestantes na segunda metade da gravidez ocorre devido ao aumento da volemia e da estase sanguínea, com aumento da permeabilidade capilar e da pressão intravascular. A conduta baseia-se em medidas paliativas, como evitar tempos prolongados na posição ortostática, repouso periódico em decúbito lateral esquerdo e, novamente, uso de meias elásticas.
- Câimbras: Sintoma de etiologia incerta, ocorre provavelmente devido ao desequilíbrio iônico de cálcio e fósforo. É mais frequente à noite ou pela manhã, despertando a grávida, ou após o ato de se espreguiçar.
- Síndromes dolorosas: Quadro de dor abdominal baixa e lombossacra que resulta da distensão das articulações sacroilíacas e da sínfise púbica. Seu manejo consiste em corrigir a postura, evitar o ortostatismo prolongado, realizar exercícios de relaxamento, como ioga e hidromassagem, acupuntura e analgésicos (paracetamol).
- Sintomas urinários: Representados pela polaciúria e pela nictúria sem disúria, no primeiro trimestre devem-se à compressão do útero na bexiga, e, no final da gravidez, à compressão da apresentação fetal. São sintomas inócuos que dispensam tratamento específico.
- Sonolência e insônia: A sonolência é um sintoma sem etiologia conhecida e que não necessita de tratamento. A insônia pode ocorrer em gestantes mais ansiosas, pelo medo e pelas incertezas que as mudanças da gravidez podem trazer para a vida cotidiana. Nos casos mais acentuados, pode-se fazer uso de ansiolíticos em pequenas dosagens.
- Síndrome do túnel do carpo: Síndrome que ocorre devido ao edema do túnel do carpo, de etiologia não perfeitamente elucidada. Sua incidência varia de 25 a 50%. Os sintomas são dores nas mãos e parestesia à noite e no início da manhã. Costuma ser autolimitada, com melhora dos sintomas em 60% das pacientes 30 dias após o parto e em 95% 1 ano depois. O tratamento conservador é feito com imobilização da mão com tala. O tratamento cirúrgico reserva-se aos casos mais graves e, geralmente, não é realizado durante a gestação.
- Congestão nasal e epistaxes: Devido à produção aumentada de hormônios esteroides, que levam à vasodilatação e ao aumento da vascularização da mucosa nasal, surge o desconforto da congestão nasal, que é tratado geralmente com uso de soro fisiológico. A epistaxe costuma ser resolvida com leve compressão local.
- Gengivorragia: Decorrente da mesma forma da congestão da mucosa oral. Em alguns casos, pode levar a doença periodontal por hipertrofia gengival. A higiene bucal adequada, com escova de cerdas macias, é o tratamento preconizado.
- Corrimento: O corrimento fisiológico da gravidez consiste em conteúdo vaginal de consistência fluida que não causa irritação e deve-se à modificação da flora de Doderlein, maior descamação do epitélio vaginal e transudação acentuada. Tal situação não requer tratamento, o qual se reserva ao aparecimento de infecções causadas por cândida ou vaginose bacteriana.
Referências Bibliográficas:
- Cartilha da Grávida – FEBRASGO.
- Guia Prático de Condutas – Como lidar com náuseas e vômitos na gestação: recomendação da Federação Brasileira das Associações de Ginecologia e Obstetrícia – FEBRASGO.
- Manual de assistência pré-natal / Sérgio Peixoto. – 2a. Ed. – São Paulo: Federação Brasileira das Associações de Ginecologia e Obstetrícia (FEBRASGO), 2014.
3. Descrever o pré-natal de acordo com as orientações do Ministério da Saúde, sua importância e periodicidade.
O objetivo do acompanhamento pré-natal é assegurar o desenvolvimento da gestação, permitindo o parto de um recém-nascido saudável, sem impacto para a saúde materna, inclusive abordando aspectos psicossociais e as atividades educativas e preventivas. A unidade básica de saúde (UBS) deve ser a porta de entrada preferencial da gestante no sistema de saúde.
Entende-se por avaliação pré-concepcional a consulta que o casal faz antes de uma gravidez, objetivando identificar fatores de risco ou doenças que possam alterar a evolução normal de uma futura gestação. Constitui, assim, instrumento importante na melhoria dos índices de morbidade e mortalidade materna e infantil.
As atividades desenvolvidas na avaliação pré-concepcional devem incluir anamnese e exame físico, com exame ginecológico, além de alguns exames laboratoriais. A investigação dos problemas de saúde atuais e prévios e a história obstétrica são importantes para a avaliação do risco gestacional. A história clínica objetiva identificar situações de saúde que podem complicar a gravidez, como diabetes pré-gestacional, a hipertensão, as cardiopatias, os distúrbios da tireoide e os processos infecciosos, incluindo as doenças sexualmente transmissíveis (DST). O uso de medicamentos, o hábito de fumar e o uso de álcool e drogas ilícitas precisam ser verificados, e a futura gestante deve ser orientada quanto aos efeitos adversos associados. Na história familiar, destaca-se a avaliação de doenças hereditárias, pré-eclâmpsia, hipertensão e diabetes. Na história obstétrica, é importante registrar o número de gestações anteriores e de partos pré-termo, o intervalo entre os partos, o tipo de parto, o peso ao nascimento e as complicações das gestações anteriores, como abortamento, perdas fetais e hemorragias e malformações congênitas.
No exame geral, cabe verificar especialmente a pressão arterial (PA), o peso e a altura da mulher.
Podem ser instituídas ações específicas quanto aos hábitos e ao estilo de vida:
- Orientação nutricional visando à promoção do estado nutricional adequado tanto da mãe como do recém-nascido, além da adoção de práticas alimentares saudáveis;
- Orientações sobre os riscos do tabagismo e do uso rotineiro de bebidas alcoólicas e outras drogas;
- Orientações quanto ao uso de medicamentos e, se necessário mantê-los, realização da substituição para drogas com menores efeitos sobre o feto;
- Avaliação das condições de trabalho, com orientação sobre os riscos nos casos de exposição a tóxicos ambientais;
- Administração preventiva de ácido fólico desde o período pré-gestacional, para a prevenção de anormalidades congênitas do tubo neural, especialmente nas mulheres com antecedentes desse tipo de malformações (5mg, VO/dia, durante 60 a 90 dias antes da concepção);
- Orientação para registro sistemático das datas das menstruações e estímulo para que o intervalo entre as gestações seja de, no mínimo, 2 (dois) anos.
Os Estados e municípios necessitam dispor de uma rede de serviços organizada para a atenção obstétrica e neonatal, com mecanismos estabelecidos de referência e contrarreferência, garantindo-se os seguintes elementos:
1° PASSO: Iniciar o pré-natal na Atenção Primária à Saúde até́ a 12ª semana de gestação (captação precoce)
2° PASSO: Garantir os recursos humanos, físicos, materiais e técnicos necessários à atenção pré-natal.
3° PASSO: Toda gestante deve ter assegurado a solicitação, realização e avaliação em termo oportuno do resultado dos exames preconizados no atendimento pré-natal.
4° PASSO: Promover a escuta ativa da gestante e de seus (suas) acompanhantes, considerando aspectos intelectuais, emocionais, sociais e culturais e não somente um cuidado biológico: “rodas de gestantes”.
5° PASSO: Garantir o transporte público gratuito da gestante para o atendimento pré-natal, quando necessário.
6° PASSO: É direito do (a) parceiro (a) ser cuidado (realização de consultas, exames e ter acesso a informações) antes, durante e depois da gestação: “pré-natal do (a) parceiro (a)”.
7° PASSO: Garantir o acesso à unidade de referência especializada, caso seja necessário.
8° PASSO: Estimular e informar sobre os benefícios do parto fisiológico, incluindo a elaboração do “Plano de Parto”.
9° PASSO: Toda gestante tem direito de conhecer e visitar previamente o serviço de saúde no qual irá dar à luz (vinculação).
10° PASSO: As mulheres devem conhecer e exercer os direitos garantidos por lei no período gravídico-puerperal.
Condições básicas para assistência pré-natal efetiva:
- Realização de anamnese, exame físico e exames complementares indicados;
- Classificação do risco gestacional (em toda consulta) e encaminhamento, quando necessário, ao pré-natal de alto risco ou à urgência/emergência obstétrica;
- Oferta de medicamentos necessários (inclusive sulfato ferroso, para tratamento e profilaxia de anemia, e ácido fólico, com uso recomendado desde o período pré-concepcional e durante o primeiro trimestre de gestação);
- Medicamentos básicos e vacinas (contra tétano e hepatite B);
- Realização de testes rápidos na unidade básica de saúde, assim como apoio laboratorial, garantindo a realização dos exames de rotina:
Calendário de Consultas: As consultas de pré-natal poderão ser realizadas na unidade de saúde ou durante visitas domiciliares, em situações especiais.
O calendário de atendimento pré-natal deve ser programado em função dos períodos gestacionais que determinam maior risco materno e perinatal. Deve ser iniciado precocemente (1º trimestre) e ser regular e completo, garantindo-se que todas as avaliações propostas sejam realizadas e preenchendo-se o cartão da gestante e a ficha de acompanhamento pré-natal.
O número mínimo preconizado pelo Ministério da Saúde para todas as gestantes é de seis consultas, com início o mais precocemente possível, sendo assim distribuídas: Uma no 1º trimestre (até a 12ª semana), duas no 2º trimestre e três no 3º trimestre; A gestante deverá ser atendida sempre que houver uma intercorrência, independente do calendário estabelecido; Para as gestantes de alto risco, a definição do cronograma de consultas deve ser adequada a cada caso e depende diretamente do agravo em questão; Além dessas seis consultas consideradas como o mínimo adequado, a mulher deve ter ao menos um retorno puerperal.
Na primeira consulta, deve-se pesquisar os aspectos socioepidemiológicos, os antecedentes familiares, os antecedentes pessoais gerais, ginecológicos e obstétricos, além da situação da gravidez atual. Os principais componentes são: data precisa da última menstruação; regularidade dos ciclos; uso de anticoncepcionais; paridade; intercorrências clinicas, obstétricas e cirúrgicas; detalhes de gestações previas; hospitalizações anteriores; uso de medicações; história previa de DST; exposição ambiental ou ocupacional de risco; reações alérgicas; história pessoal ou familiar de doenças hereditárias/malformações; atividade sexual; uso de tabaco, álcool ou outras drogas lícitas ou ilícitas; história infecciosa prévia; vacinações prévias; história de violências.
São indispensáveis os seguintes procedimentos: avaliação nutricional (peso e cálculo do IMC), medida da pressão arterial, palpação abdominal e percepção dinâmica, medida da altura uterina, ausculta dos batimentos cardiofetais, registro dos movimentos fetais, realização do teste de estimulo sonoro simplificado, verificação da presença de edema, exame ginecológico e coleta de material para colpocitologia oncótica, exame clínico das mamas e toque vaginal de acordo com as necessidades de cada mulher e com a idade gestacional.
No exame físico, os mais importantes componentes que precisam ser incluídos na primeira visita pré-natal são os seguintes: peso, altura, pressão arterial, avaliação de mucosas, da tireoide, das mamas, dos pulmões, do coração, do abdome e das extremidades.
No exame ginecológico/obstétrico, deve-se avaliar a genitália externa, a vagina, o colo uterino e, no toque bi digital, o útero e os anexos. Após a 12a semana, deve-se medir a altura do fundo uterino no abdome. A ausculta fetal será́ possível após a 10-12 semana, com o sonar-doppler.
Nas visitas subsequentes, torna-se obrigatório medir a altura uterina, pesar a paciente, mensurar a pressão arterial, verificar a presença de anemia de mucosas, a existência de edemas e auscultar os batimentos cardíacos fetais. Deve-se avaliar o mamilo para lactação. A definição da apresentação fetal deverá ser determinada por volta da 36ª semana.
Na pesquisa de sintomas relacionados à gravidez também deverá ser questionada a existência de náuseas, vômitos, dor abdominal, constipação, cefaleia, síncope, sangramento ou corrimento vaginal, disúria, polaciúria e edemas.
As anotações deverão ser realizadas tanto no prontuário da unidade (Ficha Clínica de Pré- Natal) quanto no Cartão da Gestante. Em cada consulta, o risco obstétrico e perinatal deve ser reavaliado.
Exames por período gestacional:
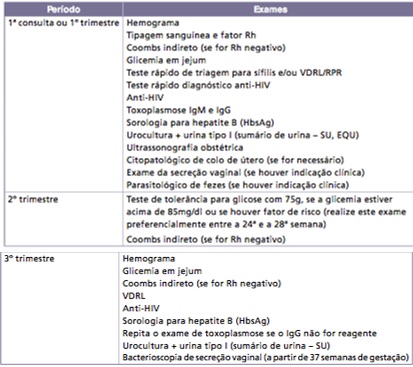
Ultrassonografia obstétrica: é um recurso útil na assistência pré-natal, mas as decisões terapêuticas devem ser baseadas no raciocínio clínico.
Caso a gestante inicie o pré-natal precocemente, o primeiro ultrassom pode ser realizado entre 10-13 semanas para avaliação de translucência nucal, como rastreamento para cromossomopatias. O segundo exame, ou na eventualidade de que apenas um seja factível ou esteja disponível, deve ser realizado entre 20-24 semanas, pois nessa época a biometria fetal indica com relativa precisão a idade gestacional e possibilita avaliação morfológica fetal. Ultrassonografias adicionais devem ser solicitadas, dependendo da suspeita clínica.
Referência Bibliográfica: Manual Técnico do Pré-Natal e Puerpério; Atenção a Gestante e a Púerpera no SUS-SP; Secretaria de Estado da Saúde de São Paulo – 2010
4. Relacionar as medidas obstétricas realizadas clinicamente com a avaliação do crescimento e vitalidade fetal. Falar do ácido fólico e do uso de vitaminas.
ÁCIDO FÓLICO
A formação e o fechamento do tubo neural ocorrem entre os dias 17 e 30 após a concepção, ou seja, de quatro a seis semanas após o primeiro dia do último período menstrual. Durante esse tempo crítico da gravidez, a medula espinal, o encéfalo, os ossos e a pele que circunda essas estruturas tem seu desenvolvimento embriológico. Um defeito do tubo neural ocorre quando o tubo neural não se fecha corretamente.
Defeito aberto do tubo neural (DATN) é a segunda anomalia congênita mais prevalente nos Estados Unidos, perdendo apenas para malformações cardíacas, e está associado com significativa morbidade e mortalidade. O DATN inclui anencefalia, espinha bífida aberta (mielomeningocele) e a encefalocele.
A anencefalia é um defeito caracterizado pela ausência da calota craniana e da pele que a recobre, de tal modo que o tubo neural da porção craniana é exposto e há degeneração secundária do encéfalo. Esse grave defeito é incompatível com a vida extrauterina, fazendo com que a maioria dos óbitos ocorra no útero ou poucas horas após o parto. A encefalocele é um defeito craniano que geralmente ocorre na região occipital, com herniação cística preenchida por líquido ou tecido cerebral. A espinha bífida aberta (mielodisplasia ou mielomeningocele) caracteriza-se pela ausência do arco neural e da pele que o recobre, com lesão secundária dos nervos expostos.
O ácido fólico é uma vitamina hidrossolúvel pertencente ao complexo B, também conhecido como vitamina B9 ou vitamina M. O folato é a forma natural encontrada nos alimentos. Apresenta papel fundamental no processo de multiplicação celular, na formação de proteínas estruturais e hemoglobina. O ácido fólico é utilizado como suplemento nutricional e na fortificação de alimentos, podendo ser transportado através de membranas. Atua como coenzima no metabolismo de aminoácidos, na síntese de purinas e pirimidinas e dos ácidos nucleicos (DNA e RNA), sendo vital para a divisão celular e síntese proteica.
A deficiência de folato pode impedir a renovação celular adequada durante um momento crítico no fechamento do tubo neural, resultando assim na sua formação incompleta. Várias evidências apoiam a hipótese da relação entre a deficiência de ácido fólico e DATN:
- O efeito do ácido fólico sobre a redução da incidência de ocorrência ou da recorrência de DATN tem sido confirmado em vários ensaios clínicos controlados.
- A administração de antagonistas do ácido fólico aumenta o risco de DATN.
- As concentrações de folato sérico e células vermelhas do sangue são mais baixas em mulheres que geram crianças com DATN do que nas demais.
- O ácido fólico desempenha um papel importante na estabilidade genômica, evitando rotura cromossômica e hipometilação de DNA.
A deficiência de ácido fólico pode determinar o acúmulo sérico de homocisteína, podendo associar-se à síndrome hipertensiva da gestação, ao descolamento prematuro de placenta, a abortamentos espontâneos de repetição, a partos prematuros, ao baixo peso ao nascer, à restrição de crescimento fetal, a algumas doenças crônicas cardiovasculares, cerebrovasculares, demência e depressão. Há evidências de que a ingestão de ácido fólico possa diminuir o risco de cânceres infantis. Recentemente, alguns autores demonstraram que a utilização de ácido fólico pode associar-se com a diminuição de partos prematuros, constatando que após a adição compulsória de ácido fólico na farinha de trigo houve discreta redução nas taxas de recém-nascidos de baixo peso e prematuros, especialmente os pré-termos extremos.
Qual a dosagem ideal recomendada para a suplementação de ácido fólico? Em 1992, o Serviço de Saúde Pública Americano recomendou que todas as mulheres em idade fértil consumissem 400 µg (0,4 miligrama) de ácido fólico sintético todos os dias para reduzir o risco de gravidez afetada por DATN. Caso houvesse antecedente de DATN ou diante de fatores de risco, a recomendação era aumentar a dosagem em 10 vezes, ou seja, 4.000 µg (4 miligramas) de ácido fólico sintético, começando 30 dias antes da concepção e continuando durante os primeiros três meses da gravidez.
Riscos: O ácido fólico, na dosagem recomendada, é seguro e não parece causar danos demonstráveis para o desenvolvimento fetal durante a gestação nem para as gestantes. Todavia, com o aumento da ingestão e da concentração sanguínea de folato na população geral, os possíveis efeitos da alta ingestão de folato estão se tornando uma importante questão de saúde pública. Os efeitos adversos de doses altas não são claramente demonstrados na literatura, mas parece haver um risco potencial da suplementação com ácido fólico em mascarar a deficiência de vitamina B12, condição que é rara em mulheres em idade reprodutiva. Outros riscos teóricos incluem interações medicamentosas, reações alérgicas e efeitos cancerígenos.
NUTRIENTES
- Calorias: No primeiro trimestre não há necessidade de aumento dessa ingesta. As recomendações de aumento de calorias ingeridas no segundo e no terceiro trimestres são de 340 kcal/dia e 452 kcal/dia, respectivamente.
- Proteínas: Há recomendação de aumento de ingesta proteica de 0,8 g/kg/dia, em não grávidas adultas, para 1,1 g/kg/dia nas gestantes, uma vez que a unidade feto-placentária consome aproximadamente 1 kg de proteínas durante a gestação.
- Carboidratos: A recomendação diária de consumo de carboidratos aumenta de 130 g/dia para 175 g/dia na gestação, em função das necessidades fetais e da passagem de glicose do compartimento materno para o fetal por difusão facilitada.
- Lipídios: A ingesta de ácidos graxos poli-insaturados de cadeia longa tem mostrado efeitos benéficos no desenvolvimento neurológico e ocular dos recém-nascidos, devendo ser usada no último trimestre da gravidez, sob a forma de alimentação baseada em peixes oleaginosos, com baixa contaminação mercurial ou mesmo comprimidos, contendo DHA. Dois são os principais ácidos graxos: o DHA (ômega 3) e o EPA (ômega 6). Os estudos mostram que o DHA, principal ácido graxo, deve ser consumido na dose de 200 mg/dia, nos últimos meses de gravidez, o que equivale a duas porções semanais de peixes como salmão, atum, albacora ou camarão
- Ferro: É recomendado um aumento no consumo diário de ferro de 15 mg/dia para 30 mg/dia na gravidez. Revisões sistemáticas têm demonstrado que a suplementação de ferro reduz em 70% o risco de anemia materna na gestação a termo.
- Ácido fólico (Vitamina B9): O fechamento do tubo neural se dá ao redor da 6ª semana de gestação, e existem evidências de que o ácido fólico é essencial na prevenção dos defeitos de fechamento de tubo neural (DTN), como espinha bífida ou meningomielocele. Na população de baixo risco recomenda-se a dose diária de 0,4 a 0,8 mg de ácido fólico. Nas populações de alto risco para DTN, a dose é de 5 mg/dia. Seu uso deve ser iniciado um mês antes da gravidez e continuado até a 12ª semana gestacional.
- Cálcio: A formação do esqueleto fetal necessita de 30 g de cálcio durante a gravidez, quantidade facilmente mobilizável do compartimento materno. Durante a gravidez, há um aumento na absorção do cálcio, o que contribui para seu acúmulo. Estudos observacionais apontaram para a diminuição na incidência da pré-eclâmpsia com a suplementação de cálcio em áreas de baixa ingesta, no entanto, outros estudos não evidenciaram os mesmos efeitos em mulheres saudáveis e bem nutridas. Assim, hoje não há indicação de suplementação universal de cálcio.
- Vitamina A: A vitamina A é lipossolúvel e importante para o desenvolvimento embrionário. Sua ausência/ deficiência está relacionada a abortamento, microcefalia, distúrbios oculares e da visão fetal. A dose diária recomendada é de 2700 ui. Seu suplemento diário, em doses menores que 10.000 ui, está relacionado à redução na anemia materna e à cegueira noturna. Doses diárias maiores que 10.000 ui podem ser teratogênicas, e o médico/nutricionista deve ter cuidado com polivitamínicos não balanceados para a gravidez.
- Vitamina D: A necessidade diária de vitamina D é de 400 a 800 ui. O uso de vitamina D na gravidez é alvo de intensa investigação no momento; no entanto, ainda não ficou comprovada sua necessidade de uso universal e os trabalhos não mostraram redução na taxa de pré-eclâmpsia, morte fetal intraútero ou morte neonatal.
- Polivitamínicos: o CDC e o Instituto de Medicina Americano recomendam o uso de polivitamínicos para mulheres que não têm uma dieta adequada. São consideradas de risco para tal situação pacientes com gestação gemelar, usuárias de drogas, tabagistas, vegetarianas estritas e aquelas com deficiência de lactase. Para as pacientes com nutrição adequada, não existem evidências da necessidade universal do uso de tais medicações.
Referências Bibliográficas:
- Guia Prático de Condutas – Recomendação sobre a Suplementação Periconcepcional de Ácido Fólico na Prevenção de Defeitos de Fechamento do Tubo Neural (ANENCEFALIA E OUTROS DEFEITOS ABERTOS DO TUBO NEURAL) – FEBRASGO.
- Manual de assistência pré-natal / Sérgio Peixoto. – 2a. Ed. – São Paulo: Federação Brasileira das Associações de Ginecologia e Obstetrícia (FEBRASGO), 2014.
5. Discutir políticas públicas referentes à gravidez.
O planejamento feito pela Prefeitura deixa as mulheres muito tranquilas para terem seus filhos na cidade. Na cidade, os projetos desenvolvidos pelo Governo Municipal são destinados às mulheres que querem engravidar e até os primeiros meses de vida do bebê.
No Progesta 12, a Prefeitura de São Caetano do Sul oferece orientações preventivas às mulheres que pretendem engravidar, num conceito de gravidez de 12 meses. As moradoras que planejam ter filho são beneficiadas, três meses antes da previsão da concepção, com um conjunto de ações como suporte nutricional (suplemento e vitaminas), realização de exames, recebimento de medicamentos e orientações físicas. Tudo para garantir um início de gestação saudável, aumentando a expectativa de uma gravidez tranquila e sem sobressaltos.
Já as gestantes de São Caetano do Sul têm à disposição uma competente rede de Unidades Básicas de Saúde (UBSs) prontas aos atendimentos de rotina, além do Centro de Atenção Integral à Saúde da Mulher (CAISM) e da Casa da Gestante (esse equipamento público atende uma média de 300 mulheres por mês) – as mulheres com gestação de alto risco fazem o acompanhamento no (CAISM), enquanto os casos comuns são encaminhados às UBSs. Quando algum problema ocorre, as moradoras e os bebês têm à disposição leitos públicos de Unidade de Terapia Intensiva (UTI) nos módulos neonatal, pediátrico e adulto. Ações que também contribuem para a pequena mortalidade no município são o aumento da cobertura vacinal; as visitas domiciliares dos profissionais de Saúde do Programa Saúde da Família (PSF); o programa Bebê Cidadão, com atendimento de um pediatra na residência da gestante sempre no período entre a saída da mamãe da maternidade e a primeira consulta agendada na rede; a promoção da Semana de Amamentação, iniciativa para orientar enfermeiros, agentes de saúde, pediatras e obstetras para os benefícios da prática; o Disque Amamentação; o Mãe Canguru; o Curso de Gestantes; e o Programa Juventude Precavida.
O Curso de Gestantes foi implantado em 2013 e consiste em palestras que são divididas em dois módulos, onde visam desenvolver capacidades naturais e instintivas da mulher, além de fortalecer o vínculo e participação dos pais no processo de gestação, parto, pós-parto e início da vida do bebê. No 1º módulo, os profissionais do grupo multidisciplinar abordam os temas Nutrição da gestante e do lactante, pré-natal de alto risco, Saúde bucal na gestação, Importância da atividade física na gestação, Aspectos psicológicos da gestação e pós-parto e Puerpério. Já no 2º, pré-natal de baixo risco, o parto, atendimento do recém-nascido na sala de parto e triagem neonatal, a alimentação nos 1.000 dias, cuidados com o bebê, amamentação e Planejamento familiar. Na oportunidade, também foram distribuídos enxovais em parceria com o Fundo Social de Solidariedade.
Ref. Bib.: Governo do Estado de São Paulo; São Caetano do Sul, Saúde. – 2010. Prefeitura Municipal de São Caetano do Sul –













Comentários