Envelhecimento
A OMS considera o envelhecer como um processo sequencial, individual, cumulativo, irreversível, universal, não patológico de deterioração de um organismo maduro, próprio a todos os membros de uma espécie, de maneira que o tempo o torne menos capaz de fazer frente ao estresse do meio ambiente e, portanto, aumente sua possibilidade de morte.
Mudanças com o envelhecimento
Embranquecimento dos cabelos e calvície; redução na estatura; aumento do diâmetro do crânio e aumento da amplitude do nariz e orelhas caracterizando a conformação facial do idoso, diminuição da espessura e perda da capacidade de sustentação da pele; alteração da cavidade bucal com perda do paladar; desgaste dos dentes. A deposição do tecido adiposo ocorre em maior concentração no tronco e ao redor de vísceras como rins e coração. Problemas relacionados à ingestão e digestão adequadas dos alimentos, diminuição da força muscular, agilidade e mobilidade das articulações; distúrbios nos sistemas respiratório, circulatório e urogenital; alteração da memória e até depressão.
Senescência
Envelhecer como um processo progressivo de diminuição de reserva funcional. Processo fisiológico com transformações graduais e deterioração física e mental do ciclo vital, que ocorrem normalmente com o passar dos anos (envelhecimento). Não se acompanha de distúrbios de conduta ou amnésia entre outros. Processo normal de envelhecimento.
Senilidade
Desenvolvimento de uma condição patológica por estresse emocional, acidente ou doenças. Deterioração patológica física ou mental do envelhecimento agravado por doenças crônicas ou outras alterações que podem determinar o processo de perda de saúde do idoso (perda da capacidade de memorizar, prestar atenção, não conseguir se orientar, etc.).
Teorias do Envelhecimento
Dentre as inúmeras teorias pode-se destacar: a Teoria Genética, a Teoria Imunológica, a Teoria do Acúmulo de Danos, a Teoria das Mutações, a Teoria do Uso e Desgaste e a Teoria dos Radicais Livres (RLs), uma das teorias mais plausíveis até o momento.
-
Teoria Genética – Dos telômeros
O mecanismo genético considerado seria o encurtamento do telômero, estrutura localizada no final dos cromossomos de células eucarióticas, como fator determinante no desencadeamento do envelhecimento, uma vez que é responsável pela proteção dos cromossomos e replicação do DNA cromossômico, o encurtamento dos telômeros também traria perdas de informações genéticas e instabilidades genômicas no decorrer da vida.
A telomerase é uma transcriptase reversa constituída de uma sequência curta de RNA que serve de molde para a síntese do telômero. Durante o processo de replicação do DNA nas células eucariotas, ocorre perda de pequena quantidade de DNA em cada extremidade do cromossomo, a cada divisão celular, resultando em encurtamento dos telômeros, em alteração estrutural e em eventual senescência replicativa.
Os telômeros são encurtados durante o crescimento replicativo em muitas culturas de células humanas nas quais a telomerase não está ativada. Essa observação levou à hipótese de que o comprimento dos telômeros regula o número de replicações da célula in vivo. Assim, o encurtamento do telômero seria o “relógio molecular” que sinalizaria a eventual senescência replicativa, observada em células humanas em cultura.
-
Teoria Imunológica
A redução da eficácia do sistema imune, mantido pela interação entre linfócitos e macrófagos no organismo, ao longo dos anos tornaria as pessoas mais suscetíveis contra as agressões, provocando assim, o envelhecimento. A diminuição da resposta imune estaria relacionada ao envelhecimento do timo, órgão central no desenvolvimento e diferenciação de Linfócitos T. Contudo é necessário haver mais pesquisas para a confirmação dessa teoria e conhecimento acerca dos linfócitos T, uma vez que as alterações imunitárias podem ser consequências e não causas do envelhecimento.
-
Teoria do Acúmulo de Danos
A principal causa do envelhecimento seria o acúmulo de moléculas defeituosas provenientes de falhas no reparo e na síntese de moléculas intracelulares com o avanço da idade, o que repercutiria na perda progressiva da função do organismo. As falhas de reparo e síntese seriam oriundas de erros na transcrição do RNA e sua tradução em proteínas, gerando uma elevação na concentração de proteínas modificadas e não funcionais, levando ao envelhecimento. Isso devido à elevação de uma ou mais bases púricas ou pirimídicas do código genético, provocando a formação de sequências errôneas de aminoácidos. Contudo não há evidências suficientemente concretas.
-
Teoria das Mutações
As sucessivas alterações que ocorrem nas células somáticas (46 cromossomos), ao transcorrer dos anos, produziriam células mutantes incapazes de cumprir suas funções biológicas, o que provocaria um declínio progressivo dos órgãos e tecidos, com instalação do envelhecimento. Esse acúmulo de células heterogêneas durante os anos seria a explicação de doenças de fundo clonal como câncer e arteriosclerose. Contudo, existem poucas pesquisas para a fundamentação dessa teoria.
-
Teoria do Uso e Desgaste
O envelhecimento seria o resultado do acúmulo de agressões ambientais do dia-a-dia, as quais ocasionariam a diminuição da capacidade do organismo em recuperar-se totalmente. Onde, os ferimentos, infecções, inflamações e outras formas de agressões sejam eles, ferimentos ou patógenos, se somariam ao longo dos anos no indivíduo e dessa forma, as lesões ocasionadas provocariam alterações nas células, tecidos e órgãos desencadeando o envelhecimento.
-
Teoria dos Radicais Livres (RLs)
O envelhecimento normal seria resultado de danos intracelulares aleatórios provocados pelos RLs, moléculas instáveis e reativas, que atacariam as diferentes biomoléculas do organismo em busca de estabilidade.
Os RLs são espécies químicas contendo um ou mais elétrons não pareados na camada de valência sendo mais reativos que as espécies com elétrons pareados. Devido a sua alta reatividade os RLs buscam, rapidamente, extrair um elétron de qualquer partícula, molécula ou átomo em sua vizinhança, a fim de recuperar a paridade e a estabilidade.
As fontes exógenas de RLs são as radiações gama e ultravioleta, os medicamentos, as bebidas alcoólicas, a dieta, o cigarro e os poluentes ambientais.
Já a fonte endógena seria em grande parte da respiração celular, que ocorre no interior da mitocôndria na presença de oxigênio, o qual sofre um desvio em seu metabolismo normal, recebendo um elétron extra, induzindo a formação dos demais RLs, demonstrando que a mitocôndria seria o principal constituinte do organismo responsável pelo envelhecimento.
O organismo possui um sistema endógeno enzimático e um sistema exógeno não enzimático, os quais promovem a manutenção do equilíbrio entre a produção e neutralização dos RLs, contudo, quando esse equilíbrio é alterado, tem-se o estresse oxidativo, em que ocorrem reações de oxidação lipídica, proteica e reações com o DNA o que provocaria modificações dos tecidos e código genético, e por consequência ocasionariam as deficiências fisiológicas características do avançar da idade e provenientes desses danos intracelulares provocados pelos RLs.
O sistema endógeno produz enzimas que convertem os radicais livres em substâncias menos reativas para neutralizarem os efeitos dos radicais livres do oxigênio. Duas dessas enzimas são a catalase e a superóxido dismutase. Além disso, alguns nutrientes, como as vitaminas E e C, o betacaroteno, o zinco e o selênio atuam como antioxidantes que removem os radicais livres do oxigênio da circulação.
Envelhecimento do Sistema Imunológico
A imunidade inata funciona como uma primeira linha de defesa do organismo. Primeiramente, a barreira epitelial previne as infecções e se essa for destruída, um grupo de células é ativado (células fagocíticas, como os monócitos, macrófagos e neutrófilos, mas também, células dendríticas e células NK). A interação dessas células com os agentes infecciosos ocorre por intermédio dos Receptores de Reconhecimento de Padrão (PRR) que, por sua vez, reconhecem os Padrões Moleculares Associados a Patógenos (PAMP).
A imunidade adquirida é altamente específica para um dado patógeno. Suas principais características são memória e especificidade. Nas respostas imunes adquiridas os linfócitos são as células que atuam na destruição de patógenos. Os linfócitos podem ser enquadrados em duas categorias básicas: linfócitos T e linfócitos B. Na imunidade mediada por células às reações são contra patógenos intracelulares normalmente, estas reações são mediadas por linfócitos e fagócitos e com pouca participação dos anticorpos. As células que compõem a imunidade celular são principalmente, os linfócitos T – divididas em duas subpopulações: CD4 e CD8. As células CD4 possuem a função de auxiliar nas respostas imunes e as que expressam o marcador CD8 são chamadas de citotóxicas e há pouca participação de anticorpos. Já a imunidade humoral é mediada por anticorpos, produzidos pelos linfócitos B. Os anticorpos são glicoproteínas.
Há vários fatores ligados à imunossenescência, mas parece que a atrofia crônica do timo induzida pela idade resulta numa diminuição na produção de células T é o fator mais importante.
Alteração da função imune é em grande parte decorrente da mudança na sua regulação e envolve predominantemente os linfócitos T, estando também associada com a disfunção das células B. Essas alterações podem ser observadas na redução do número de células T virgens e aumento dos clones de memória. Além disso, observa-se que o encurtamento do telômero não é encontrado somente em células T de memória, mas também em células T ativas.
Outra alteração na resposta imune é a mudança na relação entre células T helper 1 e 2; ocorre um aumento nas células TH-2 e diminuição das TH-1. A interleucina 2 (produto das células Th-1) sofre um declínio na sua produção.
Com a baixa proliferação dos linfócitos T, ocorre uma diminuição na produção da interleucina-2 (IL-2), importante fator de crescimento para linfócito T. As citocinas no organismo também sofrem alterações com o processo de envelhecimento, possivelmente por quebra da homeostase de sua produção e liberação.
Outros estudos mostram que há diminuição de anticorpos novos no organismo senil, decorrentes de uma capacidade proliferativa diminuída das células B. Além disso, com a diminuição de anticorpos IgG há aumento da suscetibilidade e gravidade de doenças infecciosas, e menor eficiência de vacinas em idosos, quando comparados a organismos jovens.
Envelhecimento do Sistema Respiratório
Pensa-se que o sistema respiratório seja o sistema do organismo que envelhece mais rapidamente devido à maior exposição a poluentes ambientais ao longo dos anos.
No organismo senil ocorre uma diminuição da elasticidade e complacência dos pulmões pelas modificações nos tecidos colágenos e elásticos; dilatação dos bronquíolos, ductos e sacos alveolares; atrofia dos músculos esqueléticos acessórios na respiração; redução da caixa torácica devido à rigidez torácica (difere entre homem e mulher) e diminuição da ventilação pulmonar.
A diminuição do número de alvéolos, devido à ruptura dos septos interalveolares e consequente fusão alveolar provocam a diminuição da superfície total respiratória, aumento do volume residual e complacência pulmonar.
A porção inicial da expiração permanece praticamente constante ou sofre apenas uma ligeira diminuição e mais acentuadamente que qualquer outro parâmetro, a ventilação máxima voluntária (VMV) diminui.
As alterações corporais provocam alterações pulmonares: o peso corporal e a estatura sofrem alterações que acompanham o envelhecimento e que condicionam o desempenho respiratório do idoso: a diminuição da altura, a substituição do músculo por tecido adiposo, sobretudo à volta do perímetro abdominal, as mudanças do IMC (kg//m2). Além disso, a má nutrição frequentemente conduz à fraqueza dos músculos respiratórios e, portanto, a alterações na mecânica pulmonar. O gênero também influencia o envelhecimento pulmonar.
Alterações pulmonares nos idosos podem ser resultado doenças cardiovasculares, deformações ósseas do tórax, doenças articulares, lesões do sistema nervoso central e periférico e cirurgias abdominais e torácicas. Ainda perturbações metabólicas, como acidose, diabetes mellitus e uremia.
Envelhecimento fisiológico do sistema cardiovascular
- As paredes do ventrículo esquerdo (VE) aumentam levemente de espessura, bem como o septo interventricular.
- Maior rigidez da aorta, determinando aumento na impedância ao esvaziamento do VE, com consequente aumento da pós-carga.
- Há deposição de tecido colágeno principalmente na parede posterior do VE. A infiltração colágena do miocárdio aumenta a rigidez do coração.
- Redução da complacência ventricular com prejuízo da função diastólica, ou seja, há o prolongamento do tempo de relaxamento e de contração dos ventrículos.
- As artérias sofrem alterações na elasticidade, distensibilidade e dilatação. O esvaziamento ventricular dentro da aorta endurecida favorece o aumento da pressão sistólica nos idosos. O aumento da resistência arterial periférica determina progressivo incremento da pressão arterial média. Apesar da dilatação, as paredes da aorta tornam-se mais grossas pelo aumento da infiltração de colágeno, mucopolissacarídeos e deposição de cálcio.
- A pré-carga também sofre influência do envelhecimento, pela diminuição da massa muscular, diminuição do volume sanguíneo e da eficiência das válvulas venosas, que, em conjunto, reduzem o retorno venoso.
- As estruturas valvulares tornam-se fibrosas com a idade. Os folhetos mostram-se espessados e mais rígidos, ocorrendo aumento gradual na circunferência das quatro válvulas. A calcificação é, algumas vezes, acentuada no anel valvular, produzindo um denteado irregular e grosseiro nas válvulas aórtica e mitral.
- A modulação da função cardíaca pelo sistema beta-adrenérgico diminui, ocorrendo declínio na resposta à estimulação adrenérgica do coração senescente. A resposta beta-adrenérgica reduzida leva a menor vasodilatação arterial.
Conclusivamente, é possível afirmar que, a despeito dessas alterações, a capacidade do miocárdio de gerar tensão é bem mantida. A força contrátil e o encurtamento do músculo cardíaco não se encontram prejudicados, estando a função cardiovascular global em repouso e adequada para a manutenção das atividades normais em idosos saudáveis. Por outro lado, a redução do relaxamento miocárdico, produzindo disfunção diastólica, pode pesar consideravelmente em presença de doença cardiovascular ou com o uso de certos medicamentos.
-
Pericárdio
As alterações do pericárdio são, em geral, decorrentes do desgaste progressivo, sob a forma de espessamento fibroso e aumento da taxa de gordura epicárdica.
-
Endocárdio
As alterações são o espessamento e a opacidade, com proliferação das fibras colágenas e elásticas, fragmentação e desorganização. Após os 60 anos, há focos de infiltração lipídica.
-
Miocárdio
Presença de colágeno aumentado, diâmetro fibroso aumentado e cruzamento de ligações de colágeno, com aumento na proporção de colágeno dos tipos I e III, diminuição de elastina e fibronectina aumentada, podendo ocorrer aumento na produção de matriz extracelular. A proliferação de fibroblastos é induzida por fatores de crescimento, em particular angiotensinas, fator alfa de necrose tumoral, e fator de crescimento derivado de plaquetas.
No miocárdio há acúmulo de gordura, moderada degeneração muscular com substituição das células miocárdicas por tecido fibroso. Com o passar da idade, podemos encontrar depósitos de substância amiloide que, com frequência, constitui a chamada amiloidose senil.
-
Alterações das valvas
Com o envelhecimento, observa-se degeneração e espessamento dessas estruturas. As manifestações acontecem particularmente em cúspides do coração esquerdo, sendo raras em valvas pulmonares e tricúspide.
-
Alterações da valva mitral
Calcificação e degeneração mucoide são relativamente frequentes, acometendo principalmente as valvas mitral e aórtica. A presença da degeneração mucoide ou mixomatosa torna o tecido valvar frouxo e, com isso, poderemos ter prolapso e insuficiência mitral.
-
Alterações da valva aórtica
O processo mais importante na valva aórtica é a calcificação, com alterações pouco significativas sob a forma de acúmulo de lipídios, de fibrose e de degeneração colágena.
-
Alterações do sistema de condução ou específico
O envelhecimento é acompanhado de acentuada redução das células do nó sinusal, podendo comprometer o nó atrioventricular e o feixe de His. A infiltração gordurosa separando o nó sinusal da musculatura subjacente contribui para o aparecimento de arritmia sinusal, sendo a mais frequente nessa faixa etária a fibrilação atrial. Essas alterações se instalam de forma lenta e gradual após os 60 anos.
-
Alterações da aorta
A modificação principal que ocorre, sem considerar a arteriosclerose, seria a alteração na textura do tecido elástico e aumento do colágeno.
Os processos ocorrem na camada média, sob a forma de atrofia, de descontinuidade e de desorganização das fibras elásticas, aumento de fibras colágenas e eventual deposição de cálcio. Temos redução da elasticidade, maior rigidez da parede e aumento do calibre.
Outra alteração estrutural metabólica importante é a amiloidose senil da aorta que se desenvolve independentemente da arteriosclerose, e ainda poderemos ter a calcificação da parede aórtica com graus diversos de intensidade e incidência.
-
Alterações arteriais do envelhecimento
Temos dilatação da luz do vaso, aumento da espessura da parede, rigidez das artérias elásticas com disfunção endotelial, com consequente aumento da pressão sistólica, da pressão de pulso e da velocidade da onda de pulso, levando a aumento da pós-carga.
Temos migração de células musculares lisas vasculares ativadas para a íntima, com produção aumentada de matriz, produção de colágeno com perda das fibras elásticas, aumento na fibronectina e calcificação.
O aumento da rigidez arterial leva a aumento da pós-carga diretamente pela diminuição da complacência arterial, e indiretamente acelera a velocidade de propagação da onda de pulso pelo sistema vascular, promovendo um retorno precoce ainda no período sistólico na parede da raiz da aorta, como consequência, ocorrendo um pico tardio da pressão sistólica, com aumento desta, bem como aumento da pressão de pulso e aumento da pós-carga.
-
Alterações das artérias coronárias
Perdas de tecido elástico e aumento do colágeno acumulando-se em trechos proximais das artérias. Eventualmente, ocorre depósito de lipídios com espessamento da túnica média.
No coração, a coronária esquerda altera-se antes da direita. Outra alteração significativa é a calcificação das artérias coronárias epicárdicas, observada com frequência em indivíduos muito idosos.
-
Sistema nervoso autônomo
Vários estudos demonstraram que a eficácia da modulação beta-adrenérgica sobre o coração e os vasos diminui com o envelhecimento, mesmo que os níveis de catecolaminas estejam aumentados, principalmente durante o esforço. As consequências funcionais da diminuição da influência simpática sobre o coração e vasos do idoso são observadas principalmente durante o exercício; portanto o aumento do débito cardíaco durante o esforço se obtém com dilatação cardíaca, aumentando o volume sistólico para compensar a resposta atenuada da frequência cardíaca.
-
Função cardiovascular
O débito cardíaco pode diminuir em repouso, principalmente durante o esforço, tendo influência importante do envelhecimento por meio de vários determinantes listados a seguir:
- Diminuição da resposta de elevação da frequência cardíaca ao esforço ou outro estímulo.
- Com o envelhecimento, temos diminuição da complacência do ventrículo esquerdo, com retardo no relaxamento do ventrículo, com elevação da pressão diastólica desta cavidade, levando à disfunção diastólica do idoso.
- Ocorre diminuição da complacência arterial, com aumento da resistência periférica e consequente aumento da pressão sistólica, com aumento da pós-carga dificultando a ejeção ventricular devido às alterações estruturais na vasculatura.
- Diminuição da resposta vascular ao reflexo barorreceptor, com maior suscetibilidade do idoso à hipotensão.
- Com o envelhecimento, o débito cardíaco poderá estar normal ou diminuído, sendo que o coração idoso é competente em repouso, com resposta ao esforço alterada, podendo facilmente entrar em falência quando submetido a maior demanda, como na presença de doenças cardíacas ou mesmo sistêmicas.
-
Alterações cardíacas do envelhecimento
O envelhecimento provoca diminuição de miócitos, aumento da massa do ventrículo esquerdo, aumento do átrio esquerdo.
Doença Pulmonar obstrutiva crônica
A DPOC (Doença pulmonar obstrutiva crônica) tem como fatores de risco predominantes o tabagismo e o enfisema. É uma doença crônica e progressiva que acomete os pulmões e tem como principais características a destruição de seus alvéolos. Os principais sintomas dos pacientes são a limitação do fluxo aéreo (entrada e saída do ar), principalmente na fase expiratória, a dispneia, fadiga muscular, insuficiência respiratória, entre outros.
As substâncias do tabaco provocam basicamente as seguintes alterações no sistema respiratório: estimulam a hipertrofia das glândulas submucosas determinando um aumento na secreção de muco e inibem o movimento ciliar das células epiteliais.
A limitação do fluxo aéreo pode decorrer da diminuição da retração elástica do parênquima pulmonar, hipersecreção de glândulas da mucosa e inflamação das vias aéreas levando a metaplasia. O trabalho expiratório estará aumentado.
A metaplasia pavimentosa (escamosa) é a substituição de um tecido por outro mais resistente. A metaplasia se desenvolve por meio de certa lesão (hábito de fumar) provocar mecanismos adaptativos, podendo ser estes reversíveis ou irreversíveis. Infelizmente, a metaplasia também prejudica o trato respiratório por conta da perda do aparelho mucociliar, aumentando as chances do indivíduo fumante sofrer de infecções por repetição e de desenvolver pneumonia.
Enfisema pulmonar é um tipo de doença pulmonar obstrutiva crônica (DPOC) caracterizada por danos aos alvéolos pulmonares, causando oxigenação insuficiente e acúmulo de gás carbônico no sangue. Os danos às paredes dos alvéolos reduzem o espaço capaz de fazer troca de ar.
O enfisema é caracterizado pela perda da elasticidade do tecido pulmonar, destruição dos alvéolos e seus capilares. Conforme os danos aumentam, as vias aéreas colapsam, resultando em menor superfície para trocas gasosas, levando a uma forma obstrutiva de doença pulmonar: o ar entra nos pulmões e não sai.
A diminuição da ventilação e obstrução das vias aéreas e a hiperinflação dos pulmões resultam em baixos níveis de oxigênio (hipóxia) e, eventualmente, níveis de dióxido de carbono (hipercapnia) no sangue cada vez maiores, conforme o espaço para troca gasosa reduz. Durante a hiperinflação pulmonar, o risco de inflamação das vias aéreas também aumenta, o fluxo de ar expiratório reduz e diminui ainda mais a transferência de gás. Os níveis de oxigênio no sangue progressivamente menores aumentam a frequência respiratória como resposta compensatória.
No caso do enfisema, basicamente, a complacência pulmonar aumenta e a elasticidade diminui. Sendo mais fácil o ar entrar no trato respiratório do que sair.
Aterosclerose e a resposta à lesão
Propuseram que a lesão vascular iniciaria o processo aterosclerótico. O dano endotelial foi classificado da seguinte forma:
- Tipo I – Lesão vascular envolvendo mudanças funcionais no endotélio com mínimas mudanças estruturais.
- Tipo II – Lesão vascular envolvendo rompimento endotelial com mínima trombose
- Tipo III – Lesão vascular envolvendo dano à camada média, que estimula importante trombose.
O que acontece é o aumento de expressão das moléculas de adesão, da permeabilidade endotelial e da transmigração do LDL-colesterol para dentro da íntima, bem como da diminuição do óxido nítrico. Histologicamente, isso pode ser visto como um espessamento da íntima.
A segunda etapa é a migração de partículas de LDL-colesterol através da camada endotelial para a íntima, onde estará sujeito a alterações na sua estrutura por variados fatores, um deles a oxidação por produtos derivados do estresse oxidativo. É então fagocitado através da via do receptor scavenger. Esse processo segue e resulta na formação das células espumosas. O acúmulo desse tipo de células na íntima resulta na formação das estrias gordurosas.
Na terceira etapa temos resposta inflamatória contínua. A absorção do LDL modificado pelos macrófagos é um potente estimulador para a produção e liberação de várias ocitocinas, bem como de substâncias citotóxicas.
Por sua vez, essa ação local das ocitocinas recruta mais macrófagos, células T, células musculares lisas e, em adição, um aumento ainda mais importante das moléculas de adesão endotelial e aumento na permeabilidade endotelial. Com a continuação desse processo, as células espumosas se agregam em lagos lipídicos que irão formar os núcleos da placa aterosclerótica.
A quarta etapa é a formação da capa fibrosa. Aqui temos a migração das células musculares lisas da camada média do vaso para a íntima, onde se depositam e secretam colágeno. Essas células são as responsáveis pela formação de uma parede/capa que irá separar o conteúdo lipídico do sangue circulante.
Arteriosclerose
É caracterizada pelo depósito de gordura, cálcio e outros elementos na parede das artérias, reduzindo seu calibre e trazendo um déficit sanguíneo aos tecidos irrigados por elas. Seu desenvolvimento é lento e progressivo, e é necessário haver uma obstrução arterial significativa, de cerca de 75% do calibre de uma artéria, para que surjam os primeiros sintomas isquêmicos (sintomas derivados da falta de sangue).
Tabagismo
A nicotina e monóxido de carbono afetam todo o sistema arterial produzindo vasoconstrição, aumento da frequência cardíaca, hipertensão arterial e arteriosclerose. A presença da nicotina no organismo humano provoca a liberação de catecolaminas, adrenalina e noradrenalina; quando a adrenalina é jogada no sangue, as batidas do coração ficam mais fortes e aceleradas, consequentemente aumentando a pressão arterial. O monóxido de carbono que possui 250 vezes mais afinidade pela hemoglobina do que o oxigênio formará a carboxihemoglobina, prejudicando a oxigenação dos tecidos e do miocárdio, que em conjunto com a vasoconstrição provocada pela nicotina faz com que haja o entupimento de artérias, capilares e veias.
Sedentarismo
Programas de atividade física orientada podem diminuir o risco coronário, uma vez que, para além da própria doença, exercem seus efeitos sobre os fatores de risco da doença em si: aumentam os níveis de HDL, diminuem os níveis de triglicerídeos, da pressão arterial, do peso corpóreo, melhoram a tolerância à glicose e corrigem a distribuição da gordura.
O exercício físico previne ou retarda a manifestação de hipertensão arterial e diabetes, bem como aumentam a obtenção de ganhos em massa óssea e muscular, a recuperação da flexibilidade, coordenação motora e equilíbrio favorecem a reintegração social, com proveitos consideráveis sobre os transtornos do humor e qualidade de vida.
Dislipidemia
O fenótipo lipídico aterogênico presente na Síndrome Metabólica é resultado do excesso de tecido adiposo visceral, que, devido à intensa atividade lipolítica, libera grandes quantidades de ácidos graxos livres na circulação. Em consequência, há menor depuração hepática de insulina e hiperinsulinemia sistêmica, redução na degradação da apolipoproteína B (ApoeB) e maior secreção hepática de lipoproteínas de muito baixa densidade (VLDL). Isso resulta em maior geração de LDLs pequenas e densas, diminuição do colesterol na HDL e aumento das triglicérides.
Aspectos epidemiológicos das doenças cardiovasculares dos idosos
- Fatores genéticos, dislipidemias, diabetes e vida sedentária são os principais fatores de risco para doença coronária, hipertensão arterial, insuficiência cardíaca e acidente vascular cerebral (AVC).
- A mortalidade por doenças isquêmicas do coração é a principal causa entre as mulheres. As doenças cerebrovasculares, o diabetes, enfermidades associadas ao tabagismo também são de alta relevância.
- O sedentarismo é um fator de risco prevalente em idosos com doença cardiovascular estabelecida. O risco relativo para doença coronária em sedentários varia de 1,5 a 2,4.
- Estudos mostram que os fumantes idosos apresentam menor intenção em abandonar o cigarro se comparados aos jovens, no entanto, eles apresentam maior probabilidade de sucesso quando tentam parar de fumar.
- A obesidade ou a má distribuição de gordura corporal tem sido responsabilizada pelo aumento da prevalência dos fatores de risco para a doença aterosclerótica.. O excesso de peso também está relacionado com a hipertensão arterial.
Importância dos Exercícios Físicos
O objetivo dos exercícios e da reabilitação cardiovascular no idoso é melhorar ao máximo a capacidade funcional. Programas de atividade física orientada podem diminuir o risco coronário, uma vez que, para além da própria doença, exercem seus efeitos sobre os fatores de risco da doença em si: aumentam os níveis de HDL, diminuem os níveis de triglicerídeos, da pressão arterial, do peso corpóreo, melhoram a tolerância à glicose e corrigem a distribuição da gordura. A obtenção de ganhos em massa óssea e muscular, a recuperação da flexibilidade, coordenação motora e equilíbrio favorecem a reintegração social.
Sistema Ósseo
Um osso é composto de diversos tecidos: osso ou tecido ósseo, cartilagem, tecidos conjuntivos densos, epitélio, tecido adiposo e tecido nervoso.
Funções: suporte, proteção, assistência ao movimento, homeostasia mineral, produção de células sanguíneas e armazenamento de triglicerídeos através da medula óssea amarela.
O tecido ósseo possui quatro tipos de células:
- Células osteogênicas são células-tronco não especializadas, derivadas do mesênquima. São as únicas células ósseas que sofrem divisão celular e originam os osteoblastos.
- Osteoblastos são células formadoras de osso. Sintetizam e secretam fibras colágenas e outros componentes orgânicos da matriz extracelular do tecido ósseo e iniciam a calcificação.
- Osteócitos, células ósseas maduras, são as principais células do tecido ósseo e mantém seu metabolismo diário com a troca de nutrientes e resíduos com o sangue.
- Osteoclastos são células enormes e estão no endósteo. Realizam decomposição da matriz extracelular do osso, denominada reabsorção, que é parte do desenvolvimento, da manutenção e do reparo do osso.
Metabolismo do cálcio
Aproximadamente 99% do Ca corporal encontram-se no esqueleto, principalmente sob a forma de cristais de hidroxiapatita.
O cálcio é absorvido no intestino delgado e sua concentração plasmática é medida pela ação dos hormônios 1,25-diidróxicolecalciferol (vitamina D3), calcitonina e hormônio da paratireoide (PTH), onde controlam sua absorção, excreção e o metabolismo ósseo.
Normalmente, os íons de cálcio são mal absorvidos a partir do intestino. Entretanto, a vitamina D promove a absorção de cálcio pelos intestinos e cerca de 35% do cálcio ingerido costuma ser absorvido.
O osso compõe-se de uma matriz orgânica resistente, fortalecida por depósitos de sais de cálcio. O osso compacto médio contém por peso cerca de 30% de matriz e 70% de sais. Já o osso recém-formado pode ter uma porcentagem consideravelmente maior de matriz, em relação aos sais.
Regulação da bioquímica óssea
Para homeostase do cálcio, três hormônios estão envolvidos com grande importância no controle do metabolismo: a vitamina D ativa, o paratormônio (PTH) e a calcitonina.
-
Vitamina D
A vitamina D ativa é originada do colecalciferol formado na pele pela ação não enzimática a partir do precursor 7-dehidrocolesterol, através dos raios solares ultravioletas.
A partir daí a vitamina D deve sofrer duas hidroxilações em sequência, sendo uma na posição 25 ocorrida no fígado através da 25-hidrolase e outra na posição 1, nos rins, através da 1-α-hidrolase, sendo que então a vitamina está ativa.
A vitamina D está relacionada com a absorção de cálcio e fósforo na luz intestinal, promovendo a síntese de uma proteína carreadora de Ca. Atua sobre a paratireoide, estimulando a liberação do PTH. Já os rins estimulam a reabsorção de Ca e de P. As baixas concentrações de Ca estimulam a síntese de vitamina D através da ativação da enzima 1-α-hidrolase presente nos rins.
Dessa forma, eleva-se a síntese de vitamina D ativa e aumenta a absorção de Ca no lúmen intestinal. A ação sobre os ossos promove a mobilização de Ca e P, pela ativação dos osteoclastos.
-
Paratormônio
É um hormônio secretado pela glândula paratireoide. Atua no aumento da calcemia, sendo que a secreção do PTH promove a desmineralização óssea, aumentando os níveis de Ca no sangue. Atua sobre os rins diminuindo a excreção de Ca e estimula a síntese de vitamina D ativa. O metabolismo do PTH é sensível aos níveis de Ca ou alterações na relação Ca:P quando estas ficam reduzidas.
O principal fator regulador da secreção do PTH pelas paratireoides são os níveis sanguíneos de Ca. A secreção do hormônio varia inversamente com a concentração sérica de Ca.
-
Calcitonina
Trata-se de um hormônio sintetizado nas células parafoliculares ou células C da tireoide. Seu principal efeito biológico é o de reduzir os níveis plasmáticos de Ca. A calcitonina atua nos osteoclastos, diminuindo sua atividade e consequentemente, a reabsorção óssea. Acredita-se também que esse hormônio inibe a atividade dos osteócitos e estimula os osteoblastos. A calcitonina é degradada na própria tireóide, no fígado, rins e tecido ósseo.
Processo de mineralização óssea
O estágio inicial na produção óssea consiste na secreção de moléculas de colágeno (monômeros de colágeno) e da substância fundamental (proteoglicanos) por osteoblastos. Os monômeros de colágeno formam fibras colágenas; o tecido resultante, por sua vez, transforma-se em osteóide.
À medida que o osteóide é formado, certa quantidade dos osteoblastos vem a ser encarcerada no osteóide. Nesse estágio, essas células recebem o nome dos osteócitos.
Dentre de alguns dias após a formação do osteóide, os sais de cálcio começam a precipitar sobre as superfícies das fibras colágenas. Os precipitados aparecem primeiramente espaçados ao longe de cada fibra colágena, constituindo ninhos minúsculos, que se multiplicam e se desenvolvem rapidamente no período de alguns dias a semanas, até formar o produto final, os cristais de hidroxiapatita.
O osso sofre continua deposição de osteoblastos e ininterrupta absorção nos locais onde os osteoclastos se encontrem ativos. Os osteoblastos são encontrados nas superfícies externas dos ossos e nas cavidades ósseas.
O osso também sofre uma continua absorção na presença de osteoclastos que correspondem a grandes células fagocitárias multinucleadas, derivadas de monócitos ou células semelhantes formadas na medula óssea.
Envelhecimento do sistema ósseo
Na faixa etária dos 40 anos, a quantidade de matriz óssea reabsorvida excede a quantidade formada, resultando numa diminuição da massa esquelética, e o início do envelhecimento e o processo de osteopenia fisiológica.
À medida que o teor de esteroides sexuais diminui, durante a meia-idade, especialmente nas mulheres após a menopausa, ocorre uma redução na massa óssea, porque a reabsorção supera a deposição óssea realizada pelos osteoblastos. Existem dois efeitos principais do envelhecimento sobre o tecido ósseo: perda de massa óssea e fragilidade. A perda de massa óssea resulta da desmineralização, a perda de cálcio e outros minerais da matriz extracelular óssea. O segundo efeito principal do envelhecimento sobre o sistema esquelético, a fragilidade, é consequência de uma redução na taxa de síntese proteica. A perda da resistência à tração faz com que os ossos se tomem muito quebradiços e suscetíveis a fraturas.
Antes dos 50 anos, perde-se, sobretudo osso trabecular e, após essa idade, principalmente osso cortical. Além disso, a institucionalização, uma menor mobilidade, o uso de vários agasalhos, menor exposição voluntária ao sol, maior tempo em interiores e o fato de a pele envelhecida, sob idêntica exposição solar, produzir menor quantidade de vitamina D, havendo grande deficiência desta.
Osteoporose
Doença sistêmica progressiva caracterizada por diminuição da massa óssea e deterioração da microarquitetura, levando à fragilidade do osso e aumentando o risco de fraturas.
Durante a vida adulta, ocorrem ciclos equilibrados de reabsorção óssea seguidos de formação óssea. Quando ocorre um desequilíbrio entre a atividade dos osteoblastos e dos osteoclastos, isto é, do remodelamento ósseo, favorecendo a reabsorção óssea, desenvolve-se a osteoporose.
Na osteoporose senil ocorre diminuição do potencial replicativo e biossintético dos osteoblastos juntamente à perda da potência biológica das proteínas ligadas à matriz extracelular (fatores de crescimento). Há ainda diminuição da atividade replicativa das células osteoprogenitoras.
Na osteoporose pós-menopausa acredita-se que a reabsorção acelerada do osso decorrente da escassez de estrogênio cause supressão do hormônio paratireoideano, reduzindo a formação de 1,25-diidroxivitamina D e diminuindo a absorção de cálcio pelo intestino. Também é necessário compreender os efeitos do estrogênio sobre o remodelamento ósseo.
Acredita-se que os efeitos do estrogênio estejam ligados a um sistema de moléculas chamadas ligantes do receptor do ativador do fator nuclear-кB (RANKL), pelo seu receptor (RANK) e por seu receptor solúvel, a osteoprotegerina. O RANKL é expresso na superfície dos precursores de osteoblastos, enquanto o RANK é expresso na superfície dos precursores de osteoclastos. Na presença de fator estimulante de colônias de macrófagos, ocorre ligação do RANK ao RANKL, proporcionando a diferenciação de precursores de osteoclastos em osteoclastos maduros.
A osteoprotegerina liga-se ao RANKL, impedindo essa diferenciação em osteoclastos maduros. É aí que se encontra a ação do estrogênio: na ausência deste, ocorre diminuição da produção de osteoprotegerina, aumentando a expressão de RANKL nas células precursoras de osteoblastos, aumentando a diferenciação de osteoclastos maduros, e consequentemente, levando a reabsorção óssea.
A deficiência de estrogênio aumenta ainda a produção esquelética de citocinas capazes de induzir a reabsorção óssea, como IL-1, IL-6 e TNF e reduz a produção esquelética de fatores de crescimento que induzem a formação óssea.
O tratamento é feito através do aumento do consumo de cálcio por via da alimentação e suplementação. Suplementação de vitamina D – favorece a formação óssea e facilita a absorção intestinal do cálcio. Reposição hormonal de estrógeno – bloqueia a perda acelerada de osso medular.
Osteopenia
A osteopenia é o termo médico utilizado para designar a baixa densidade óssea que tem como consequência grave a osteoporose. Também pode ser acompanhada de doenças endócrinas.
Osteomalácia
É um enfraquecimento dos ossos devido a problemas de formação óssea ou do processo de construção óssea. Caracterizada pela deficiência mineralização da matriz osteóide do osso cortical e trabecular com acumulo do tecido osteóide pouco mineralizado. A causa mais comum é a falta de vitamina D.
Envelhecimento Articular
A cartilagem articular (CA), produto de secreção dos condrócitos, é formada por uma matriz de colágeno tipo II altamente hidratada, conjuntamente com agregados de proteoglicanos que atuam como uma verdadeira mola biológica.
O envelhecimento cartilaginoso traz consigo um menor poder de agregação dos proteoglicanos, aliado a uma menor resistência mecânica da cartilagem; o colágeno adquire menor hidratação, maior resistência à colagenase e maior afinidade pelo cálcio.
Os principais agentes da degradação cartilaginosa são as metaloproteases (MMP), e as enzimas colagenase, gelatinase e estromelisina; Das citocinas, destaque-se a ação catabólica da interleucina-1 (a mais importante!), da interleucina-6 e do TNF-a (fator de necrose tumoral alfa).
Os condrócitos de idosos têm menor capacidade de proliferação e possibilidade reduzida de formar tecido novo. Observou-se que, com o aumento da idade, ocorre um decréscimo tanto de atividade mitótica quanto do comprimento médio do telômero, ao lado de maior atividade de b-galactosidase (um marcador de senescência). Esses achados comprovam a ocorrência de senescência na capacidade replicativa dos condrócitos.
Nos discos intervertebrais a degeneração aumenta com o envelhecimento, estando aumentados a fibronectina e seus fragmentos, substâncias que estimulam as células para a produção de metaloproteases e citocinas que inibem a síntese de matriz intercelular. Com referência à membrana sinovial há um aumento do colágeno com o envelhecimento.
Osteoartrite
A doença articular degenerativa/osteoartrite/osteoartrose é considerada uma insuficiência da articulação, com o comprometimento de todas as estruturas que as formam.
-
Fisiopatologia da osteoartrite
A patogenia da OA envolve os processos de destruição e reparação da cartilagem visto que a remodelação é um processo contínuo na cartilagem normal. Os elementos da matriz são constantemente degradados por enzimas autolíticas e repostos por novas moléculas pelos condrócitos. Na OA, esse processo é alterado e, em consequência disso, há um desequilíbrio entre a formação e a destruição da matriz, com um aumento desta última.
Na OA, os condrócitos têm papel chave no equilíbrio entre a produção e a degradação da matriz cartilaginosa e, por consequência, da manutenção da função da cartilagem. São responsáveis pela síntese dos elementos da matriz extracelular (MEC), mas também são eles os responsáveis pela produção das enzimas proteolíticas que as quebram.
Quando fatores mecânicos induzem o aumento da expressão de citocinas inflamatórias, e biológicos atuam rompendo esse equilíbrio, com predomínio da destruição, surge então a OA. A perda local de proteoglicanos e da molécula do colágeno tipo II ocorre inicialmente na superfície da cartilagem, levando a um aumento no conteúdo de água e perda da força de tensão da MEC na medida em que a lesão progride.
O processo pode ser iniciado por uma série de eventos que acarretam a alteração da função do condrócito, com fortes evidências de que os estímulos aos condrócitos seriam ocasionados por citocinas pró-inflamatórias, especialmente a IL-1b e o TNF-a. Os condrócitos liberam enzimas proteolíticas que degradam os elementos da matriz cartilaginosa, causando adelgaçamento da cartilagem e deterioração da sua qualidade mecânica.
Artrite reumatoide
A artrite reumatoide é uma doença autoimune. O principal alvo são as células sinoviais das articulações, podendo atacar outro sítios também, causando inchaço, dor e eritema. A doença é sistêmica e crônica.
-
Fisiopatologia da artrite
A AR é o resultado de uma complexa interação entre fatores ambientais e genéticos. Entre os fatores ambientais estão a infecção por agentes virais ou bacterianos e o hábito tabagístico. Quanto à genética, sabemos que não é uma doença passada diretamente de pais para filhos. O que é herdado na verdade são alguns genes que atribuem maior propensão ao desenvolvimento da doença e estão no HLA, um complexo de genes relacionados ao sistema imunológico de cada pessoa. Os linfócitos estão produzindo anticorpos contra as células do próprio corpo e também, citocinas (como o TNF-alfa) que atuam junto aos anticorpos lesando as articulações e atraindo mais anticorpos. Elas causam a inflamação da membrana sinovial, com a progressão da inflamação, as estruturas próximas como a cartilagem, principal tecido estrutural da articulação, os ossos, os tendões e os ligamentos podem ser lesados, causando erosões e deformidades.
Tratamentos não medicamentosos
Osteoporose
Alongamento de pescoço, tríceps, musculo peitoral, músculos e glúteos, panturrilha, ísquios, músculo quadríceps. Além disso, é indicado realizar treino de equilíbrio e coordenação motora e que realize a caminhada no mínimo por 40 minutos por quatro vezes na semana. Também é fundamental que tenha uma mudança na dieta, para maior ingestão de cálcio, exposição solar por pelo menos 15 minutos diariamente. O emprego da fisioterapia também é bastante importante, levando em consideração que alivia as dores, melhora a mobilidade, auxilia os efeitos psicossociais e previne perdas ósseas adicionais.
Artrite
A fisioterapia e a terapia ocupacional contribuem para que o paciente possa continuar a exercer as atividades da vida diária. A proteção articular deve garantir o fortalecimento da musculatura e adequado programa de flexibilidade, evitando o excesso de movimento e privilegiando cargas moderadas. O condicionamento físico, envolvendo atividade aeróbica, exercícios resistidos, alongamento e relaxamento, deve ser estimulado observando-se os critérios de tolerância ao exercício e a fadiga.
Uso prolongado de AIE/AINES
- AINES
Seu mecanismo de ação consiste em inibir a enzima COX-1 e COX-2 de ácidos graxos, inibindo desse modo a produção de prostaglandinas e tromboxanos. A COX-1 é uma enzima expressa na maioria dos tecidos, inclusive nas plaquetas do sangue. Ela desempenha funções de “manutenção” no organismo, estando envolvida em especial na homeostase dos tecidos, e é responsável, por exemplo, pela produção de prostaglandinas com funções em citoproteção gástrica, agregação plaquetária, autorregulação do fluxo sanguíneo renal e no início do parto.
Já a COX-2 é induzida principalmente nas células inflamatórias quando ativadas, por exemplo, pelas citocinas inflamatórias (IL)-1 e (TNF)-α.
O consumo crônico de AINEs pode causar nefropatia analgésica, caracterizada por nefrite crônica e necrose papilar renal. Sob a ação dos AINEs também ocorre diminuição da proteção estomacal, o fluxo sanguíneo renal é dificultado, pois ocorre vasoconstrição.
- AIE (glicocorticoides)
Os esteroides sintéticos possuem efeito igual ao do cortisol e ligam-se às proteínas receptoras intracelulares específicas, formando o complexo ligante-receptor, que é transportado para o núcleo, onde interage com o DNA e com proteínas nucleares. Com isso haverá transcrição de fatores de transcrição, que atuam sobre fatores de crescimento, citocinas e mediam os efeitos de anti-crescimento, anti-inflamatórios e imunosupressores dos glicocorticoides.
Nos efeitos hormonais dos AIEs está a gênese de alguns tipos de diabetes e hipertensão; do ganho de peso iatrogênico, da insuficiência adrenal, de algumas formas de úlceras pépticas, do surgimento de sangramentos digestivos, de estrias no abdome, da osteoporose (provavelmente, por antagonizar efeitos da vitamina D), do surgimento de edemas, do excesso de pelos no corpo, da obesidade tipo central, com o tronco obeso e membros finos, dentre outros.
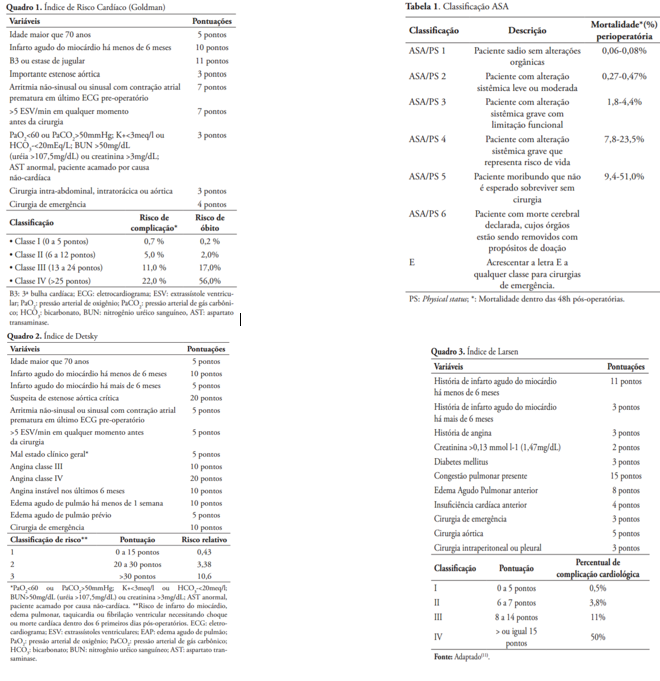
Avaliação de risco cirúrgico
Os eventos cardiovasculares são as principais causas de mortalidade pós-operatória em cirurgias não cardíacas. Para estimar o risco cardiovascular em cada caso, foram criados diversos escores de risco.
Essa avaliação deve ser capaz de estimar possíveis riscos decorrentes do procedimento cirúrgico em cada paciente e, se possível, orientar condutas que possam minimiza-los. Esta estimativa é importante para oferecer ao cirurgião/equipe e paciente/família informação que devem ser levadas em conta na comparação entre possíveis benefícios e malefícios do procedimento em cada caso.
Epidemiologia de quedas em idosos
- As internações por fraturas superam aquelas por cardiopatia isquêmica, diabetes ou neoplasias.
- Os dados revelam moderada incidência de fratura de quadril em indivíduos acima de 50 anos de idade, mas elevada prevalência de todos os tipos de fratura por fragilidade óssea, variando de 11% a 24%.
- A dificuldade para realizar atividades físicas aumentou o risco de fraturas em cerca de três vezes. Quanto maior a dificuldade, maior o risco.
- A prevalência de quedas associou-se com idade avançada, sedentarismo, e maior número de medicações referidas para uso contínuo.
Estatuto do idoso
O implemento das políticas públicas e a efetiva garantia dos direitos sociais da pessoa idosa, certamente assegurará um envelhecimento saudável e com dignidade. A Política Nacional do Idoso (Lei 8842/1994) tem como objetivo assegurar a pessoa idosa seus direitos sociais, criando condições para promover sua autonomia, integração e participação efetiva na sociedade.
O Estatuto possui 118 artigos que abrangem os direitos fundamentais das pessoas idosas,sendo: saúde física e mental, social e moral, com liberdade e dignidade. Nenhum idoso será objeto de negligencia discriminação, crueldade, violência ou opressão. Pelo envelhecimento ser um direito, sua proteção é um direito social. É obrigação do estado e da sociedade assegurar liberdade, respeito á dignidade e os direito civis (como o de ir e vir por exemplo).
Envelhecimento do Sistema Nervoso
Alterações
- A partir da segunda década de vida inicia-se um declínio no peso do encéfalo discreto e lentamente progressivo, em torno de 1,4 a 1,7% por década. Nas mulheres, o declínio é mais precoce que nos homens.
- Alterações morfológicas da substância branca e corpo caloso resultam em perda de grandes e pequenos neurônios e/ou retração dos grandes neurônios corticais.
- O RNA citoplasmático se reduz regularmente com a idade nos neurônios do córtex frontal, giro hipocampal, células piramidais do hipocampo e células de Purkinje do cerebelo, entre outros.
- Retração do corpo celular (pericário) dos grandes neurônios.
- Adelgaçamento da espessura cortical.
- O número de células nervosas decresce com o envelhecimento normal.
- Depósito de lipofucsina nas células nervosas.
- Depósito amiloide (prejudica a função do órgão) nos vasos sanguíneos e células.
- Aparecimento de placas senis e de emaranhados neurofibrilares.
- Declínio do metabolismo da glicose é seguido por uma redução de cerca de 20% do tamanho médio das células nervosas do córtex cerebral.
- Sulcos corticais: alargamento e aprofundamento; hipertrofia maior no lobo frontal e temporal.
- Diminuição de 20% dos terminais pré-sinápticos do córtex após os 60 anos.
Demências
O que é?
Ocorrência de déficits de múltiplas funções cognitivas que causem declínio significativo nos níveis prévios de cognição. Habitualmente ocorre um déficit de memória (capacidade prejudicada de reter novas informações ou de recordar informações anteriormente aprendidas) e pelo menos um dos seguintes déficits:
- Agnosia – dificuldades sensoriais;
2. Apraxia – dificuldade para executar atividades motoras, apesar de a função motora estar intacta;
3. Afasia – alterações da linguagem;
4. Transtornos das funções executivas (planejamento, sequenciamento, organização).
Delirium
É definido como uma síndrome cerebral orgânica sem etiologia específica caracterizada pela presença simultânea de perturbações da consciência e da atenção, da percepção, do pensamento, da memória, do comportamento psicomotor, das emoções e do ritmo sono-vigília. A duração é variável e a gravidade varia de formas leves a formas muito graves.
Doença de Alzheimer
A causa suspeita até o momento diz respeito às mutações nos genes da presenilina (I e II) e no gene da proteína percursora do amiloide (APP) que afetam a proteína percursora do amiloide e seu metabolismo, contribuindo com a hipótese do depósito da substancia amiloide para o surgimento da doença de Alzheimer.
O acúmulo de substância amiloide causa as chamadas placas amiloides no tecido cerebral e morte celular.
Nos estágios iniciais, podemos encontrar perda de memória episódica e dificuldades no aprendizado de novas informações, evoluindo gradualmente com prejuízos em outras funções cognitivas, como julgamento, por exemplo.
Nos estágios intermediários, pode ocorrer apraxia ou disfasia, apresentando-se como anomia ou dificuldades para escolher a palavra adequada para expressar uma ideia. Nos estágios mais avançados, encontram-se alterações no ciclo sono-vigília, alterações comportamentais – irritabilidade, agressividade, delírios e alucinações; e incapacidade de realizar cuidados pessoais.
- Mecanismo genético
Relacionados com a DA de duas formas: fator determinante – formas autossômicas dominantes de início precoce em determinadas famílias; e fator de risco para o desenvolvimento da DA esporádica de início tardio.
Foi localizado um locus no cromossomo 19 associado com a doença, onde foi identificado um gene que codifica a apolipoproteína E (APOE). Esse gene tem três alelos designados como APOE-e2, APOE-e3 e APOE-e4. A presença de uma cópia de APOE-e4 aumenta o risco de DA tardia em três vezes, enquanto a presença de duas cópias em cerca de doze vezes.
- Mecanismo ligado ao beta-amiloide e a proteína tau
Há muito já se sabe que a placa senil tem como constituinte principal uma deposição de substância amiloide no espaço extracelular e que a degeneração neurofibrilar ocorre por agregação da proteína tau.
A tau é uma proteína associada aos microtúbulos, estabilizando-os em condições normais. Quando ocorre hiperfosforilação da proteína tau ela se dissocia dos microtúbulos e se agrega sob a forma de filamentos helicoidais pareados insolúveis e estes nos emaranhados neurofibrilares (ENF). Quando se expressa no interior dos neurônios comprometidos, a APOE-4 altera a fosforilação da tau, que leva a formação de ENF, causa ruptura da estrutura do citoesqueleto, desregula diversas vias de sinalização e compromete a função mitocôndria. A desintegração dos microtúbulos dificulta o transporte neuronal, causando, posteriormente, a morte neuronal.
Doença de Lewy
- Demência de pelo menos 6 meses de duração com declínio cognitivo flutuante, acompanhada por períodos de confusão.
- Alucinações – especialmente visuais.
- Quedas frequentes.
Os achados patológicos são os corpúsculos de Lewy, que são inclusões intracitoplasmáticas eosinofílicas hialinas, encontradas geralmente no córtex cerebral e no tronco encefálico, neocorticais e uma quantidade variável de eventos patológicos relacionados com DA, como placas senis e, em menor extensão, emaranhados neurofibrilares.
Demência vascular
A demência vascular pode ter início agudo, seguida por uma sucessão de acidentes vasculares cerebrais por trombose, embolia ou hemorragia. Geralmente é resultado de grandes lesões causadas quando um coágulo bloqueia a passagem de sangue no cérebro (acidente vascular cerebral isquêmico). Caso esse coágulo tenha sido formado por arritmia cardíaca será classificada como demência por infartos múltiplos.
Demência frontotemporal
A demência frontotemporal é uma perturbação degenerativa que apresenta um quadro clínico exclusivo, com alterações de linguagem, de personalidade e de comportamento. Tem um início insidioso e é de caráter progressivo. Nos casos de perturbação frontotemporal, a memória e as habilidades visuais e espaciais encontram-se relativamente preservadas, o que a distingue da doença de Alzheimer.
As pessoas que sofrem desta desordem mental têm muitos problemas comportamentais e sociais. Dos sintomas principais que a caracterizam, destacam-se os seguintes: dificuldade em se manter socialmente ativo, comportamento compulsivo e repetitivo, alterações ao nível da fala e do discurso, descuido da higiene pessoal, apatia, desordem do pensamento e mudança de personalidade.
Reflexo e controle da micção
A contração da bexiga resulta da ativação de neurônios parassimpáticos localizados no segmento medular S2-S4, de onde impulsos eferentes seguem pelos nervos pélvico e hipogástrico até o músculo detrusor. Esse mecanismo é mediado pela estimulação de receptores muscarínicos (colinérgicos) aí localizados.
A inervação simpática da bexiga origina-se do segmento medular T11-L2, de onde fibras eferentes cruzam a cadeia simpática paravertebral nos níveis T12, L1 e L2, e prosseguem pelos nervos esplâncnicos lombares até o plexo hipogástrico.
Neste local, fazem sinapses com neurônios pós-ganglionares e daí se dirigem para inervar a região do corpo vesical, do trígono, do esfíncter interno até os meatos uretrais. A resposta do trato urinário inferior ao estímulo simpático depende da distribuição dos receptores adrenérgicos nessa região. No corpo vesical, onde os receptores beta-2 são abundantes, a excitação do simpático provoca relaxamento. Na base, onde predominam os receptores alfa-1, provoca a contração do colo vesical e da uretra.
A inervação somática para o esfíncter externo e para os músculos do soalho pélvico é fornecida pelo nervo pudendo, cujas fibras se originam nos neurônios motores no núcleo de Onuf, localizado na coluna anterior da medula sacral (S2-S4).
As funções de armazenamento e eliminação da urina são coordenadas por estruturas localizadas nos segmentos superiores do sistema nervoso, notadamente nas regiões medial, dorsolateral e ventral da ponte, onde se localizam o centro pontino da micção (CPM), e o centro pontino esfincteriano (CPE).
O CPM tem ação facilitadora sobre a micção, e o CPE age sobre a continência. O centro cortical da micção, localizado na face lateral do giro pré-central, exerce ação inibitória sobre o músculo detrusor, Os núcleos da base, o hipotálamo e o cerebelo também exercem influência sobre a micção.
O processo de armazenamento e eliminação da urina envolve funções opostas entre a uretra e a bexiga. Durante a fase de armazenamento, o impulso simpático alfa-adrenérgico mantém o tônus da região esfincteriana elevado, enquanto o impulso beta mantém o detrusor relaxado; simultaneamente, a inervação somática mantém os músculos do soalho pélvico e o esfíncter externo contraídos, enquanto o parassimpático permanece inibido. Quando o volume vesical alcança de 150 a 300 mL (ou seja, bexiga se enche), o mecanismo se inverte: o simpático é inibido, enquanto o parassimpático é estimulado, provocando contração do detrusor e expulsão da urina. Todo esse processo funciona sob a coordenação dos centros encefálicos, como foi descrito anteriormente.
Envelhecimento do sistema geniturinário
- Diminuição do peso do rim, com redução da área de filtração glomerular.
- Os vasos renais sofrem progressiva esclerose, levando a uma diminuição da sua luz.
- Redução dos glomérulos. Além da redução em número e volume, os glomérulos sofrem diminuição da área de filtração e da permeabilidade glomerulares, o que proporciona a diminuição do ritmo de filtração glomerular.
- Diminuição do comprimento e do volume dos túbulos renais, provavelmente em decorrência de isquemia.
- Diminuição do aporte de sangue renal.
- A origem embriológica comum da bexiga, uretra, do ureter e trato genital responde, na mulher, a estímulo estrogênico, cujo declínio de produção que acompanha o climatério pode trazer consequências fisiológicas, participando como facilitador do aparecimento, por exemplo, de infecções urinárias.
- Nos homens, em associação aos processos degenerativos próprios, a bexiga está vulnerável, principalmente, ao aumento prostático e à consequente acentuação do prejuízo aos processos primários do seu envelhecimento.
Incontinência urinária
Epidemiologia
A prevalência e a gravidade da incontinência urinária aumentam com o envelhecimento e são maiores entre as mulheres (23 a 32%) do que entre os homens (17 a 21%).
Impacto do envelhecimento sobre a micção
- Na bexiga: Redução da capacidade, hiperatividade e redução da contratilidade do detrusor.
- Na uretra: Redução da pressão de fechamento uretral.
- Na próstata: Aumento do volume.
- Aumento da produção noturna de urina.
- Redução da produção de estrógenos na mulher.
Classificação
- Incontinência de urgência e bexiga hiperativa: Caracteriza-se clinicamente por intenso desejo de urinar (urgência), seguido da perda involuntária de volume de urina. É desencadeada por contrações não inibidas da bexiga, referidas como hiperatividade do detrusor.
- Incontinência de esforço: ocorre quando aumentos na pressão intra-abdominal superam a pressão de fechamento esfincteriano, na ausência de contrações vesicais. É causada, na mulher, por deslocamento da uretra de sua posição anatômica durante esforços (hipermotilidade uretral); no homem, ocorre por deficiência esfincteriana.
- Incontinência por transbordamento (hiperfluxo): Quadro de gotejamento ou perda contínua de urina, associada a esvaziamento vesical incompleto, jato urinário fraco, esforço miccional, intermitência, hesitação, frequência e noctúria. A incontinência por transbordamento é provocada por dois mecanismos distintos: hipocontratilidade do detrusor e obstrução da saída vesical.
- Incontinência mista: Esta modalidade refere-se à coexistência de mais de um tipo de incontinência em um mesmo paciente.
- Incontinência funcional: Trata-se da incontinência que acomete pacientes sem comprometimento dos mecanismos controladores da micção. Deve-se à incapacidade desses pacientes para alcançar o toalete a tempo de evitar a perda de urina, seja por limitações físicas, transtornos psíquicos, déficit cognitivo, hostilidade ou limitações ambientais.
Hiperplasia prostática benigna
Caracteriza-se pelo aumento do estroma e das glândulas prostáticas na zona transicional. Os sintomas são: aumento da frequência urinária (polaciúria), noctúria (urina muito durante a noite), urgência/incontinência urinária, enurese noturna (emissão involuntária de urina – xixi na cama), jato fraco, bífido ou intermitente, hesitação, esforço miccional e gotejamento terminal.
Anemia do Idoso
Por conceito, anemia é uma síndrome clínica causada pela redução na massa circulante de hemácias. Na prática, as medidas disponíveis que estimam a massa de hemácias, mais comumente utilizadas, são a concentração de hemoglobina (Hb), hematócrito e contagem das hemácias/amostra de sangue.
A anemia no idoso pode ainda estar relacionada com síndrome de fragilidade. A análise desses estudos revelou que níveis baixos e “normal/baixo” (critérios da OMS) foram associados de maneira independente a um aumento do risco da síndrome de fragilidade. A presença de doença cardiovascular concomitante à anemia aumentou ainda mais o risco da síndrome de fragilidade, o que pode sugerir que, na ausência de um desses dois fatores, a chance de desenvolvimento da síndrome de fragilidade possa ser menor. A associação da anemia no idoso com declínio cognitivo, sintomas depressivos e diminuição na qualidade de vida foi demonstrada em alguns estudos observacionais. A associação da anemia a complicações de algumas condições clínicas, como a doença renal crônica, a doença cardiovascular (insuficiência cardíaca e a disfunção diastólica em pacientes com doença coronariana, com função sistólica preservada) torna-se cada vez mais evidente.
Além disso, os resultados de estudos publicados até esta data mostram cada vez mais que a anemia no idoso está associada a outros marcadores de declínio da condição física, como a fragilidade, a fraqueza muscular e as quedas. Anemia causada por deficiência nutricional é a mais recorrente (deficiência de ferro, vitamina B12 e folato).
Há várias causas de anemia por deficiência de ferro. Acredita-se, no entanto, que a perda crônica de sangue pelo trato gastrintestinal no idoso seja o mais comum. Embora a redução na absorção, associada ou não, à baixa ingestão de ferro possa causar deficiência, essa é uma causa incomum de anemia. Portanto, é prudente pensar que, em uma condição de anemia por deficiência de ferro, a mesma reflita perda sanguínea, e que lesões do trato gastrintestinal possam ser a causa.
Os sintomas típicos de anemia, como fadiga, fraqueza e dispneia, são inespecíficos e, em idosos, tendem a ser atribuídos à própria velhice. A palidez da mucosa conjuntival é um sinal importante e sua presença deve dar início à investigação.




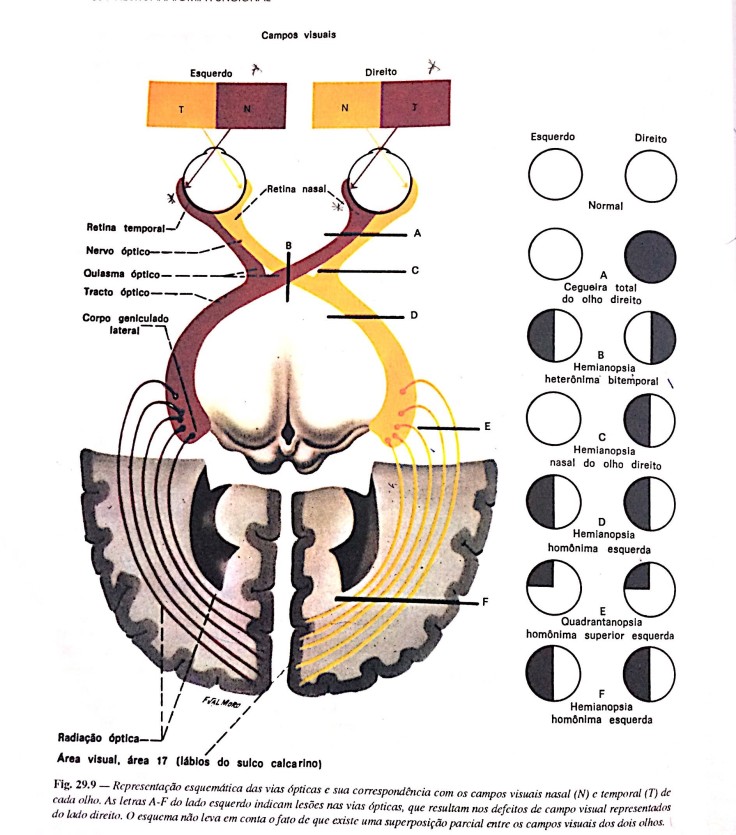



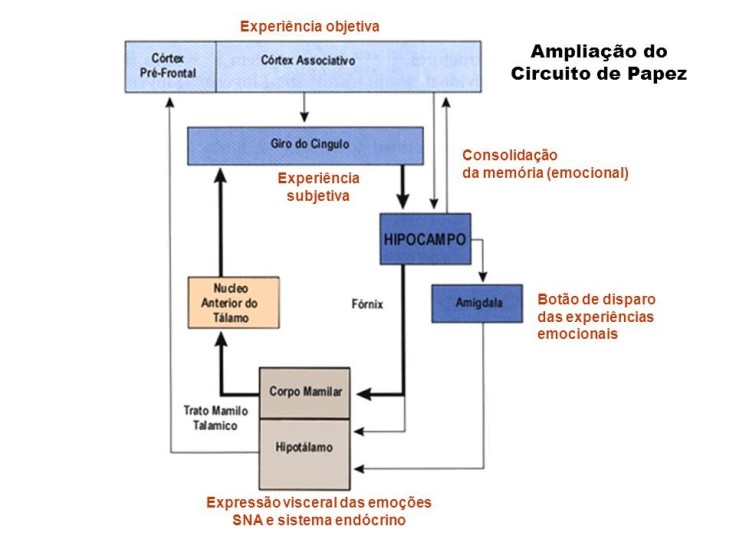
 mo e disse que estes compunham um circuito.
mo e disse que estes compunham um circuito.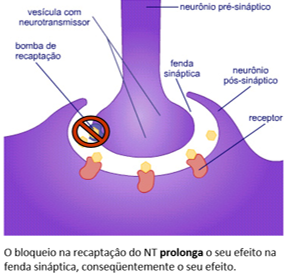




























Comentários