- O sistema imune é formado por uma tríade: barreiras físicas, sistema imune inato e sistema imune adaptativo.
- Barreiras físicas imunológicas:
- Pele: a queratina impede a entrada de microrganismos.
- Muco: adere os microrganismos. Presente na vagina, na cavidade nasal e no trato respiratório.
- Cílios do epitélio respiratório: “varrem” os microrganismos.
- Saliva e lágrimas: possuem enzimas com ação bactericida, impedindo a proliferação de microrganismos.
- Comensais: No intestino e na vagina há numerosos microrganismos da flora normal que impedem a proliferação de microrganismos externos, competindo por comida e espaço.
- Tosse, espirros, diarreia e vômitos: mecanismos para “jogar fora” os microrganismos do corpo.
- Colônias bacterianas fisiológicas das vias aéreas
- A colonização bacteriana refere-se à presença de bactérias em um determinado local do organismo sem provocar resposta ativa do hospedeiro à sua presença.
- Função da microbiota: Impedir a colonização por patógenos do meio externo e o possível desenvolvimento, estimulação do sistema imune, papel no metabolismo e na nutrição humana e ajudar na absorção de nutrientes.
- Nasofaringe: A microbiota normal do nariz normalmente ocorre nas narinas. S. aureus e S. epidermidis são as espécies predominantes e são encontradas aproximadamente na mesma quantidade que na pele e no rosto. A nasofaringe pode conter pequenas quantidades de bactérias potencialmente patogênicas, tais como Streptococcus pneumoniae, Neisseria meningitidis e Haemophilus influenzae. Difteróides, um grupo extenso de bactérias Gram positivas não patogênicas, são comumente encontradas tanto no nariz quanto na nasofaringe.
- Orofaringe: Assim como o nariz há uma grande quantidade de S. aureus e S. epidermidis colonizando esta área. As bactérias mais importantes encontradas nesta região pertencem ao grupo dos estreptococos alfa-hemolíticos (S. oralis, S. milleri, S. gordonii e S. salivarius); difteróides; Branhamella catarrhalis; uma pequena quantidade de cocos Gram-negativos, como Neisseria meningitidis.
- O palato e as tonsilas apresentam microbiota bastante similar, com exceção das criptas tonsilares onde são encontrados Micrococcus e os anaeróbios Porphyromonas, Prevotella e Fusobacterium.
- A boca é colonizada horas após o nascimento. Inicialmente é composta por Streptococcus, Neisseria, Actinomyces, Veillonella e Lactobacillus. Algumas leveduras também estão presentes.
- Trato respiratório inferior: A mucosa desta região não tem flora normal devido a remoção mecânica dos microorganismos pelo fluxo de muco, dirigido pelos cílios em direção ao trato superior. Esta remoção é bastante eficiente. As poucas bactérias que atravessam essa barreira são geralmente capturadas e destruídas pelos macrófagos.
- Maturação do sistema imune
- Origem do sistema linfoide: O sistema imune humano surge no embrião do tecido associado ao intestino. As células-tronco pluripotentes hematopoiéticas aparecem no saco vitelínico com 2-3 semanas de gestação e migram para o fígado fetal na 5ª semana. Mais tarde, passam a residir na medula óssea, onde permanecem a vida toda. O desenvolvimento dos órgãos linfoides primários (timo e medula óssea) inicia-se na metade do 1º trimestre e prossegue. Logo após, ocorre o desenvolvimento dos órgãos linfoides secundários (baço, linfonodos, amigdalas, etc). Estes órgãos continuam a ser locais de diferenciação de linfócitos T, B e células NK a partir de células-tronco.
- Desenvolvimento e diferenciação das células B: Antes de 7 semanas de gestação inicia-se o desenvolvimento das células B no fígado fetal.
- Com 14 semanas de vida embrionária já possui linfócitos circulantes com IgM e IgD.
- Desenvolvimento das células NK: Aparecem em células hepáticas com 8-11 semanas.
- Desenvolvimento dos órgãos linfoides: O timo é maior com relação ao tamanho do corpo durante a vida fetal e ao nascimento aumenta. Atinge sua maior massa antes da puberdade e depois sofre involução gradual. Com 1 ano de idade, todas as estruturas linfoides estão histologicamente maduras.
- As contagens absolutas de linfócitos no sangue periférico também atingem um valor máximo durante o primeiro ano de vida.
- O tecido linfoide periférico aumenta rapidamente no lactente e atinge o tamanho do adulto aproximadamente aos 6 anos de idade.
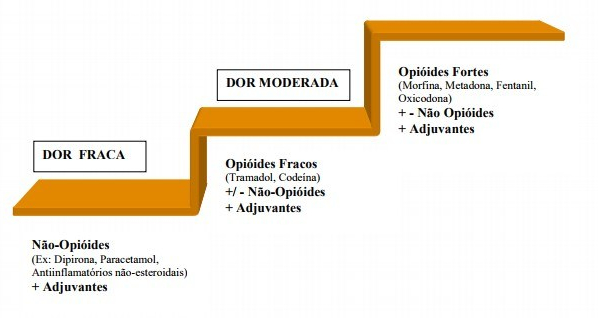
Escada da Dor – OMS
A Escada Analgésica da OMS demonstra a organização do tratamento da dor em uma escada de três degraus de acordo com a intensidade de dor que o paciente refere.
Primeiro degrau: medicamentos analgésicos simples e anti-inflamatórios para dores fracas.
Segundo degrau: opioides fracos, que podem ser associados a analgésicos simples ou anti-inflamatórios do 1º degrau.
Terceiro degrau: c opioides fortes, associados ou não aos analgésicos simples ou anti-inflamatórios.
**Adjuvantes podem ser usados nos três degraus da escada.
Princípios da Escada Analgésica OMS
- Pela Escada:
- Para dores agudas: usar como primeira opção os 3º ou 2º degraus no início da hospitalização ou após procedimentos cirúrgicos/dolorosos. Levando sempre em consideração a mensuração da dor pelo paciente (de 0 a 10). Continuar descendo a escada conforme progressão do caso.
- Para dores crônicas: Começa-se pelo 1º degrau para dores fracas. Se não há melhora, adiciona-se um opioide fraco. Se ainda assim não houver melhora, opta-se por um opioide forte como adjuvante.
- Via Oral: Os analgésicos devem ser administrados de preferência pela via oral.
- Intervalos Fixos: Os analgésicos devem ser administrados a intervalos regulares de tempo. A dose seguinte deve ser administrada antes que o efeito da dose anterior tenha finalizado.
- Individualização: Caso a analgesia seja insuficiente, deve-se subir a escada analgésica e trocar a classe medicamentosa.
- Atenção aos detalhes: Explicar detalhadamente ao paciente sobre complicações, modo de utilizar a medicação, efeitos adversos e o que mais for necessário.
Ref. Bib.: Diretrizes Assistenciais – Diretriz de Tratamento Farmacológico da Dor. Hospital Albert Einstein. 2012.
Dor neoplásica
Dor oncológica é uma expressão utilizada para caracterizar a dor de um paciente com câncer, que pode estar relacionada ao desenvolvimento da doença ou do sofrimento psíquico imposto por ela.
Não só a tumoração no câncer avançado é responsável pela dor, assim como a terapia – quimioterapia, cirurgia, radiação – participa ativamente na piora do quadro doloroso.
O sofrimento desses pacientes reverbera-se com isolamento, preocupações, pensamentos negativos, medo da morte e pode se tornar ainda mais importante do que a doença de base.
ETIOLOGIA
- Infiltração óssea. O crescimento tumoral ou as fraturas secundárias podem ocasionar lesão, compressão, tração ou laceração das estruturas nervosas, ocasionando dor isquêmica, dor neuropática periférica ou dor mielopática. A dor óssea se manifesta com sensação de dolorimento constante, profundo, às vezes contínuo, e surge com os movimentos (dor incidental).
- Compressão ou infiltração de nervos periféricos. A infiltração ou compressão de troncos, plexos e/ou raízes nervosas pelo tumor, linfonodos e/ou fraturas ósseas metastáticas pode determinar dor aguda de forte intensidade, resultando em plexopatia, radiculopatia ou neuropatia, ou seja, dor na distribuição da estrutura nervosa acometida, com apresentação de dor em queimação, contínua, hiperestesia, disestesia e perda progressiva da sensibilidade.
- Infiltração do neuroeixo (SNC). Pode ocorrer dor por invasão tumoral na medula espinal, no encéfalo e em suas meninges. A dor radicular surge por compressão ou infiltração da medula espinal, com alteração motora, sensitiva e autonômica distais ao local da lesão. Podemos observar, além da dor radicular, a primeira manifestação do comprometimento raquimedular, a dor mielopática localizada e a dor-fantasma.
- Infiltração e oclusão de vasos sangüíneos e linfáticos. As células tumorais podem infiltrar e/ou ocluir os vasos sangüíneos e linfáticos, ocasionando vasoespasmo, linfangite e possível irritação nos nervos aferentes perivasculares. O crescimento tumoral nas proximidades dos vasos sangüíneos leva à oclusão desses vasos parcial ou totalmente, produzindo estase venosa ou isquemia arterial, ou ambos
- Infiltração de vísceras ocas ou invasão de sistemas ductais de vísceras sólidas. A oclusão de órgãos dos sistemas digestório, urinário e reprodutivo (estômago, intestinos, vias biliares, ureteres, bexiga e útero) produz obstrução do esvaziamento visceral e determina contratura da musculatura lisa, espasmo muscular e isquemia, produzindo dor visceral difusa (tipo cólica) constante, com sensação de peso ou pobremente localizada, referida nas áreas de inervação da víscera comprometida.
Dor causada pelo tratamento – Cerca de 19% dos pacientes com câncer apresentam dor secundária ao tratamento:
- Dor pós-cirúrgica. Na fase aguda, a dor decorre do processo inflamatório traumático de cirurgias, como toracotomias, esternotomias, amputações e mastectomias. Na fase crônica, a dor ocorre devido ao câncer recidivado localmente. O trauma ocasionado em estruturas nervosas, durante o procedimento cirúrgico, resulta, comumente, em dor persistente além do normal, chamada neuralgia pós-cirúrgica, geralmente, decorre de fibrose cicatricial ou compressões.
- Dor pós-radioterapia. A dor pós-radioterapia apresenta-se como exacerbação aguda de dor crônica relacionada ao posicionamento para a terapia, queimaduras cutâneas, neuropatia actínica, mielopatia actínica, sinal de Lhermitté (desmielinização transitória da medula cervical ou torácica), mucosite bucal, esofagite, produção de tumores primários de nervos periféricos secundários à radiação, obstrução intestinal parcial e infarto ou isquemia intestinal.
- Dor pós-quimioterapia. A dor pode ocorrer por polineuropatias periféricas, causadas por drogas imunossupressoras, podendo ser de caráter transitório ou definitivo.
FISIOPATOLOGIA
a) Resposta inflamatória local e sistêmica:
Produção de citocinas pró-inflamatórias, que facilitam a transmissão da dor.
b) Dor diretamente relacionada ao tumor:
- As células cancerosas podem causar a invasão de tecidos sensíveis a estímulo mecânico (por exemplo, dor visceral) ou encarceramento ou lesão de nervos (por exemplo, dor neuropática);
- Os tumores contêm células do sistema imune que liberam fatores tais como a endotelina, as prostaglandinas e o fator de necrose tumoral alfa (TNF-α), que excitam ou sensibilizam aferentes primários nociceptivos periféricos.
- Os tumores liberam prótons, causando acidez local, com efeitos similares.
- A dor contínua induz e pode parcialmente ser mantida por um estado de sensibilização central.
- As enzimas proteolíticas produzidas por células do tumor podem danificar as fibras neurais sensoriais e simpáticas, causando dor neuropática.
c) Dor óssea induzida por câncer metastático:
- Lesão ou infiltração dos neurônios sensitivos que inervam a medula óssea causa dor.
- Tumores tem capacidade de alterar o metabolismo normal do osso, com perda de mecanismos que regulam o equilíbrio entre a atividade osteoclástica e osteoblástica. Com doença avançada, o osso perde a força mecânica e é sujeito a osteólise, fratura patológica, e microfraturas.
- Distorção mecânica do periósteo.
d) Neuropatia: a neuropatia associada à quimioterapia surge devido a diferentes mecanismos, incluindo:
- Ruptura da função tubulínica por agentes quimioterápicos, com liberação das citocinas, tendo por resultado a degeneração dos neurônios sensitivos e a sensibilização dos aferentes nociceptivos primários
- Radioterapia, que pode causar fibrose de tecido com compressão de nervo e obstrução microvascular do nervo. A compressão ou a lesão do tecido nervoso contribui para a sensibilização central.
Referências:
- THOMAZ, Adriana. Dor Oncológica: Conceitualização e Tratamento Farmacológico. Revista de Oncologia, 2010.
- NETO ALVES, Onofre; JACOBSEN, Manoel Teixeira; DE SIQUEIRA, José Tadeu; COSTA, Carlos Maurício de Castro. Dor: Princípios e Prática. Editora Artmed AS, 2009.
Alfa-adrenérgicos/alfa-bloqueadores
São medicamentos antagonistas dos receptores adrenérgicos.
O seu mecanismo de ação é bloquear os receptores alfa adrenérgicos, causando diminuição inicial do débito cardíaco, redução da secreção da renina, readaptação dos barorreceptores e diminuição das catecolaminas nas sinapses nervosas.
Apresentam efeito hipotensor discreto em longo prazo como monoterapia, devendo, portanto, ser associados com outros anti-hipertensivos. Podem induzir ao aparecimento de tolerância, o que exige o uso de doses gradativamente crescentes. Têm a vantagem de propiciar melhora discreta no metabolismo lipídico e glicídico e dos sintomas de pacientes com hipertrofia prostática benigna.
Efeitos colaterais:
- Broncoespasmo
- Bradicardia
- Distúrbio da condução atrioventricular
- Vasoconstrição periférico
- Insônia, pesadelos, depressão psíquica
- Astenia
- Disfunção sexual
- Intolerância à glicose
Tansulan
É um tipo de alfa bloqueador. Portanto, atua reduzindo a tensão da musculatura da próstata e da uretra e então facilita a saída da urina.
Efeitos colaterais:
- Tontura
- Distúrbios de ejaculação
- Cefaleia
- Palpitações
- Hipotensão ortostática
- Rinite
- Constipação, diarreia, náusea e vômitos
- Rash, prurido e urticaria
- Astenia
- Sincope
REFERENCIAS BIBLIOGRÁFICAS:
- Bula do cloridrato de tansulosina.
- Guia informativo sobre os medicamentos genéricos.
- Revista Brasileira de Hipertensão. VI Diretrizes Brasileiras de Hipertensão.
Antiespasmódicos
É um medicamento utilizado para a redução da motilidade da musculatura visceral. São antiespasmódicas devido a sua ação anticolinérgica.
Os antagonistas colinérgicos (muscarínicos ou nicotínicos) se ligam aos colinorreceptores, mas não causam os usuais efeitos intracelulares mediados pelos receptores.
Esses fármacos antimuscarínicos bloqueiam os receptores muscarínicos, causando a inibição de todas as funções muscarínicas. Eles também bloqueiam os poucos neurônios simpáticos excepcionais que são colinérgicos, como os que inervam as glândulas salivares e sudoríparas.
Butilbrometo de escopolamina: Age bloqueando os receptores muscarínicos da acetilcolina (antagonista muscarínico) da musculatura lisa, impedindo a sua contração, diminuindo dor e desconforto gástrico. Pode ser associada com analgésicos como paracetamol ou dipirona a fim de otimizar a diminuição do estímulo da dor.
Efeitos adversos:
- Xerostomia
- Desconforto abdominal
- Constipação
- Confusão mental
- Sonolência
- Cefaleia
- Inquietação e tontura
- Palpitação
- Taquicardia
- Hipotensão ortostática
Nefrolítiase
Mais conhecido como cálculo renal; é uma massa cristalina que se forma nos rins e tem tamanho suficiente para ser clinicamente detectável, ou pelos sintomas ou através de exames de imagem.
Os cálculos urinários são cada vez mais prevalentes, com um risco de 12% em homens e 6% em mulheres de desenvolver doença sintomática durante a vida, apresentando taxa de recorrência de cerca de 50% dos pacientes, com mais da metade deles com recorrência apresentando história familiar de cólicas nefréticas.
A cólica nefrética é a dor na região lombar e no flanco causada por obstrução total ou parcial das vias urinárias por cálculos, podendo ser associada a quadros infecciosos e de disfunção renal. Pacientes com história de cólica nefrética prévia têm risco três vezes maior de apresentar um novo episódio. Em geral ocorre um primeiro episódio de cólica nefrética a partir dos 20 anos de idade, com pico de incidência por volta de 40-60 anos e urna incidência de três casos a cada mil pessoas ao ano.
Formação e tipos de cálculo
O componente mais comum desses cálculos é o oxalato de cálcio, mas estruturas de fosfato de cálcio, ácido úrico, estruvita e cistina também podem ser encontradas. Com menor frequência, os cálculos podem ser compostos pelo uso de medicamentos, como o aciclovir, o indinavir e trianterene.
Os cálculos urinários são formados pela agregação de cristais com uma proteína não cristalina. Esses cristais se agregam para formar um cálculo. Quando atingem um determinado tamanho, esses cálculos podem migrar pelo ureter causando dor em forma de cólica durante o trajeto.
Oitenta por cento dos cálculos contêm cálcio, a maioria geralmente sob a forma de oxalato de cálcio (60%). O fosfato de cálcio, por sua vez, é responsável por cerca de 20% dos cálculos urinários. Já os cálculos de ácido úrico correspondem a cerca de 7%, e outros 7% são secundários a quadro infeccioso e formados por fosfato de magnésio amoniano.
- Cálculos de ácido úrico:
Mesmo que a excreção de ácido úrico seja importante para a formação do cálculo, o que determina a supersaturação e a formação desse tipo de cálculo, é o pH urinário.
A persistência do pH urinário abaixo de 5,5, ou seja, ácido, contribuiu para essa formação. Obesidade, diabetes melito tipo 2 e alto consumo de proteínas animais, contribuem para a diminuição do pH.
- Cálculo de estruvita:
Conhecidos por cálculos de infecção ou de fosfato triplo, são formados quando a porção superior do trato urinário é infectada por bactérias produtoras de uréase. A hidrólise da ureia pela uréase leva à instalação de um pH urinário suprefisiólogico, maior que 8, e à formação da estruvita.
A remoção completa desse tipo de cálculo só é conseguida por meio de intervenções cirúrgicas. Uma combinação entre a nefrolitotomia percutânea e a litotripsia extracorpórea por ondas de choque é recomendada.
- Cálculos de cistina:
Se formam em indivíduos que possuem uma doença rara autossômica recessiva em que a reabsorção renal tubular proximal dos aminoácidos dibásicos filtrados é deficiente. A cistina é pouco solúvel na urina.
- Riscos
Diversos fatores alimentares aumentam o risco da formação de nefrolitíase: proteína de origem animal, oxalato, sódio, sacarose e vitamina C. A baixa ingestão de cálcio também aumenta o risco da formação, pois, o baixo consumo de Ca aumenta a absorção e excreção urinária de oxalato. O que parece diminuir o risco é a ingestão de cálcio e de potássio.
Pessoas que apresentam histórico familiar são duas vezes mais suscetíveis à formação do cálculo renal; aparentemente, um único polimorfismo de nucleotídeos no gene claudina-14 está associado a um risco mais elevado.
- Formação – patogênese
É resultante de um complexo processo físico-químico que leva à cristalização. A formação de cristais na urina é principalmente uma função de sobressaturação, uma concentração acima da solubilidade do material em água.
Alguns estudos mostram que cálculos iniciais de oxalato de cálcio se formam no interstício medular e são compostos por fosfato de cálcio. Os cristais erodem junto às papilas (placa de Randall) e agem como nichos para a deposição do oxalato de cálcio.
A teoria mais aceita sobre a formação de cálculos urinários é que ela ocorre quando materiais minerais normalmente solúveis, como o cálcio e o oxalato, hipersaturam a urina, o que leva à agregação deles, que podem se tornar grandes o bastante para se ancorar no trato urinário (em geral nos coletores distais) com aumento progressivo de seu tamanho com a incorporação de mais cristais.
Outra teoria aceita é que os cálculos são inicialmente produzidos na medula intersticial renal e saem das papilas renais formando uma placa em que, posteriormente, outros cristais se agregam. Já cálculos de estruvita, cistina e ácido úrico têm fisiopatologia diferente em sua formação.
Fatores modificáveis: pH, volume e inibidores. O aumento do volume a mais de 2L/dia reduz a supersaturação e a incidência desse tipo de cálculos. Os compostos que estabilizam a cristalização e previnem a sua ocorrência dentro dos túbulos e do trato urinário ainda não foram completamente caracterizados, mas incluem o citrato e as proteínas urinárias.
Quadro clínico
Pode levar de semanas a meses para ser formado e atingir um tamanho para ser detectável. O quadro clinico é mais atribuído ao movimento do cálculo pelo ureter, do que em relação a sua formação.
A cólica nefrética ocorre por conta da obstrução do ureter, pelo cálculo. Portanto, o termo cólica ureteral seria mais adequado. A dor é causada pelo espasmo do ureter; ocorre ainda obstrução e distensão do ureter e cápsula renal. Outras causas comuns de dor similar da mesma etiologia incluem obstrução por coágulos sanguíneos e por causas extrínsecas.
A apresentação clínica é na forma de uma dor aguda, em cólica localizada em região lombar abaixo da décima segunda costela, com irradiação para a virilha ou as gónadas genitais. Inicialmente, o quadro doloroso pode ser mal localizado em região abdominal, e em algumas horas em geral ele é localizado. Posteriormente, a dor pode modificar sua posição conforme a trajetória de descenso do cálculo indo para a região abdominal sobre o cálculo ou genitais. Náuseas e vômitos são ocorrência comum associada nesses pacientes.
- Dor súbita no flanco
- Dor lombar variável e intensa, em cólica
- Náusea
- Vomito
- A dor irradia para diferentes pontos do organismo, dependendo da localização do cálculo
- Cálculo na porção superior do ureter: se irradia anteriormente
- Cálculo na extremidade inferior do ureter: se irradia para o testículo ipsilateral em homens e para o lábio vaginal ipsilateral nas mulheres
- Cálculo alojado na junção ureterovesical: frequência e urgência urinárias
- Hematúria macroscópica sem dor
- Ardência para urinar
- Paciente não é capaz de encontrar uma posição confortável
- Sensibilidade costovertebral ipsilateral
- Quando provoca obstrução urinária:
- Sinais de infecção e sepse.
Diagnóstico
- Leucocitose no hemograma
- Presença de eritrócitos e leucócitos na urina, e as vezes, cristais
- Radiografia simples: quando radiopaco
- USG abdominal: só é observado os rins e eventualmente, o segmento proximal dos ureteres. Não detecta os cálculos ureterais
- Tomografia computadorizada helicoidal:
Alta sensibilidade; dispensa uso de contrastes e permite visualizar cálculos de ácido úrico. Detecta cálculos com menos de 1mm, identificando formações que não seriam observadas à urografia excretora. Pode revelar um cálculo ureteral ou evidencias de sua passagem recente.
Diagnóstico diferencial
- Cálculo na junção uretopélvico: sintomas semelhantes à cistite aguda
- Cálculo no ureter distal direito: pode simular apendicite aguda
- Cálculo na junção ureterovesical: pode mimetizar cistite aguda
- Cálculo no ureter distal esquerdo: pode mimetizar diverticulite
- Cálculo obstrutivo associado à infecção proximal: similar a pielonefrite aguda
- Outras doenças que devem ser consideradas para o diagnóstico diferencial: dor musculoesquelética, herpes-zóster, úlcera duodenal, aneurisma da aorta abdominal, afecções ginecológicas, estenose uretral e obstrução uretral por materiais que não sejam cálculos (coágulos de sangue ou descamações papilares)
Tratamento
Como é um quadro bastante doloroso, o controle da dor é uma prioridade após a confirmação do diagnóstico definitivo. É mais frequente o uso de terapia parenteral, pois as náuseas e vômitos podem impedir o uso de medicação oral. Narcóticos (morfina e hidromorfina são os mais comuns utilizados) e AINES (ketorolac e ibuprofeno são os mais utilizados) tem sido igualmente eficaz. Os AINES são preferidos por causa dos efeitos colaterais.
Terapia medicamentosa:
- Narcóticos
- AINES
- Analgésicos
- Antieméticos
- Fluidos intravenosos – aumenta o fluxo ureteral e a probabilidade do cálculo ser eliminado
- Manutenção da hidratação intravenosa
Terapia cirúrgica:
A abordagem utilizada para a remoção do cálculo é determinada por seu tamanho, sua localização e sua composição.
A abordagem menos invasiva é a litotripsia por ondas de choque extracorpórea (LECO) que são geradas do lado de fora e são dirigidas ao cálculo usando fluoroscopia ou ultrassom. As ondas fragmentam as pedras em pedaços menos que podem migrar mais facilmente.
A nefrolitotomia percutânea é a técnica com maior probabilidade de manter pacientes livres de cálculos, mas é mais invasiva do que os métodos cistoscópicos. Essas novas abordagens endoscópicas virtualmente eliminaram a necessidade de realização de procedimentos cirúrgicos abertos, como a ureterolitotomia e a pielolitotomia.
REFERÊNCIAS BIBLIOGRÁFICAS
- Goldman L, Ausiello D. Cecil: Tratado de Medicina Interna. 24ªEdição. Rio de Janeiro: ELSEVIER, 2014.
- Martins, Htrlon Saraiva Medicina de emergências: abordagem prática / Herfoo Saraiva Martins, Rodrigo Antonio Brandão Neto, lrineu Tadeu Vdasco. — 11. ed. rev. e atual. ·· Barucrl, SP: Manole, 2016.
Dor irradiada, referida e visceral…
Diferença: dor irradiada e dor referida.
- Dor irradiada
- Se manifesta ao longo de um trajeto nervoso onde está ocorrendo o estímulo. Ex. pulpite de um pré-molar causar dor irradiada na mandíbula.
- Caracteriza‐se por ser sentida a distância de sua origem, porém ocorrendo obrigatoriamente em estruturas inervadas pela raiz nervosa ou em nervo cuja estimulação nóxica é responsável pela dor. Um exemplo clássico é a ciatalgia, provocada pela compressão de uma raiz nervosa por uma hérnia de disco lombar e que irradia seguindo seu trajeto: nádegas, coxas, perna e pé.
- A dor irradiada, também chamada de dor radicular, é produzida pelo estiramento, torção, compressão ou irritação de uma raiz espinhal, central ao forame intervertebral. Apesar de possuir muitas das características da dor referida, ela difere quanto à intensidade, aos fatores agravantes e atenuantes e ao tipo de disseminação.
- Suas características são de uma dor aguda e muito intensa, que quase sempre se inicia em uma região central, próxima à coluna, e se dirige para uma parte da extremidade inferior. Seu melhor exemplo é a compressão da 4ª e da 5ª raízes lombares e 1ª raíz sacral por uma hérnia de disco intervertebral, produzindo a dor ciática. Ela se estende caudalmente através da parte posterior da coxa, ântero-lateral e posterior da perna até o pé.
- Parestesia ou perda da sensibilidade da pele e diminuição da sensibilidade de algumas regiões ao longo do nervo geralmente estão associadas. Se coexistir envolvimento das raízes anteriores, podem, ainda, ocorrer perda de reflexos, atrofia, diminuição da força muscular, fasciculações e edema de estase.
- Ações que causam estiramento do nervo (flexão do tronco sobre as pernas estendidas, elevação das pernas em extensão) ou aumento da pressão intra-espinhal (compressão da veia jugular, tosse, espirro) agravam a dor radicular. Existe, na literatura, muita confusão entre dor referida e irradiada, chegando alguns autores a usá-las, inclusive, como sinônimos.
-> Dor referida
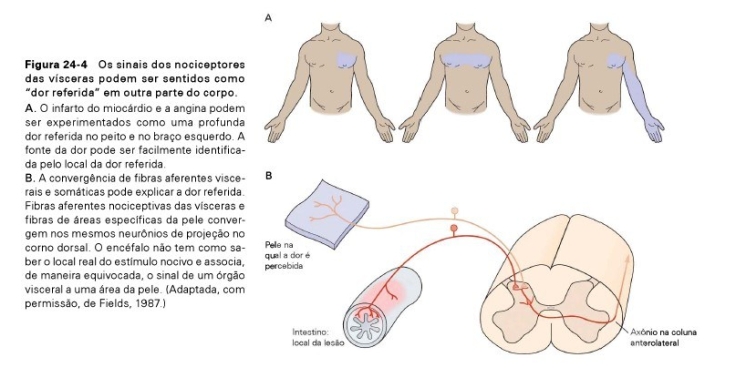
- Se manifesta distante do local onde está ocorrendo o estímulo (fig. 24.3 e 48.6). Existem várias teorias que tentam explicar a dor referida: A possibilidade de uma única célula nervosa fazer sinapse com várias outras e vice-versa gera um fenômeno conhecido como convergência ou divergência sináptica (24.3). O resultado disto é que o SNC pode projetar dor para área diferente daquela onde ocorre o estímulo. A teoria mais comumente encontrada na literatura para explicar a dor referida é a organização metamérica do organismo dos mamíferos durante a vida embrionária. Cada segmento transverso do corpo, chamado de metâmero, compreende uma porção da pele chamada dermátomo, do osso chamada esclerótomo, do músculo chamado miótomo e das vísceras chamada viscerótomo. Cada metâmero recebe inervação oriunda do segmento espinhal correspondente. Com o desenvolvimento do organismo, esta disposição metamérica se modifica e o resultado disto é que na vida adulta a pele e o músculo de um membro, por exemplo, acabam ficando distantes da víscera à qual estavam associados, mas são inervados pela mesma raiz nervosa, daí a dor do infarto ser referida ao braço e à mão. Raciocínio idêntico ocorre com a face, onde a maxila e a mandíbula pertencem ao mesmo metâmero, do que resulta a possibilidade da pulpite de um dente inferior causar dor referida num dente superior.
- Durante o desenvolvimento embrionário, estruturas mesodérmicas pares dispostas ao longo do eixo corporal, chamadas segmentos dermatoméricos, diferenciam-se em tecidos que se distribuem abaixo do epitélio ou entre as vísceras. Apesar desse distanciamento físico, elas preservam no sistema nervoso central os seus pontos de inervação. Essa convergência possibilita que a aferência nociceptiva de uma víscera facilite a condução da sensibilidade nociceptiva de uma área da superfície corporal. Por este motivo, a dor gerada pela isquemia do miocárdio é referida como uma dor presente na porção superior do tórax, ombro e porção lateral do pescoço, que se irradia para o braço, principalmente na porção esquerda do indivíduo. Em muitas situações, o comprometimento de uma víscera sensibiliza, por liberação de elementos pró-inflamatórios, as membranas próximas ou que as revestem, como o peritônio parietal, a pleura e o pericárdio. A dor é conduzida pelos nervos espinais, gerando uma sensação que é localizada na região estimulada. Dessa forma, um apêndice inflamado gera uma dor dupla, referida como contínua e em cólica na região ao redor do umbigo, por meio de sua aferência visceral simpática, e uma dor aguda no quadrante inferior direito do abdome, por sua aferência espinal, a partir do peritônio.
- É interessante observar que os axônios de nociceptores viscerais entram na medula espinhal pelo mesmo trajeto que os de nociceptores cutâneos. Na medula espinhal, ocorre uma mistura substancial da informação dessas duas fontes de aferências. Essa linha cruzada origina o fenômeno dor referida, no qual a ativação do nociceptor visceral é percebida como uma sensação cutânea.
Dor visceral
Dor visceral ocorre quando os estímulos que vão produzir a sensação de dor provêm das vísceras. Ao contrário da dor somática, a dor visceral é causada quase unicamente por distensão ou estiramento dos órgãos.
- Dor visceral referida – É transmitida pela via visceral propriamente dita, que leva à percepção da sensação dolorosa em regiões distantes do órgão de origem da dor no ponto do segmento medular onde ela se insere no corno posterior da medula. É sentida como se fosse superficial, porque esta via faz sinapse na medula espinhal com alguns dos mesmos neurônios de segunda ordem que recebem fibras de dor da pele. Assim, quando as viscerais para a dor são estimuladas, os sinais de dor das vísceras são conduzidos por pelo menos alguns dos mesmos neurônios que conduzem sinais de dor procedentes da pele. Frequentemente, a dor visceral referida é sentida no segmento dermatotópico do qual o órgão visceral se originou embriologicamente. Isso se explica pela área que primeiro codificou a sensação de dor no córtex cerebral. Um exemplo, seria a cólica de origem renal que é comum o paciente sentir dor na face interna da coxa.
- Dor visceral direta – É transmitida pela via parietal, a partir do peritônio parietal, pleura ou pericárdio, que leva à percepção da dor diretamente sobre a área dolorosa.
A dor visceral é causada por alterações internas de órgãos ocos e cápsula de vísceras sólidas, tais com o estômago, rim, bexiga, vesícula biliar, cápsula hepática, intestinos, entre outros. Os principais fatores que estimulam as fibras nociceptivas viscerais são:
- “Estiramento” ou “tensão ” na parede muscular das vísceras ocas e cápsula das vísceras sólidas. Anormalidades motoras intestinais que geram pressões intraluminais exageradas são as causas mais comuns de dor visceral.
- Processo inflamatório de origem infecciosa ou química (colites, pancreatites, entre outras).
A dor visceral tem algumas peculiaridades que a torna, ao mesmo tempo, complexa e única. Uma dessas características é a pouca capacidade que o ser humano tem em identificar com precisão a origem da dor visceral. A dor tem localização geralmente difusa nas proximidades do órgão afetado ou mesmo à distância. Isso pode ser explicado pelo fato de que os estímulos viscerais penetram em diferentes segmentos da medula espinal, onde se juntam com fibras oriundas de estruturas somáticas.
Por isso mesmo, a dor visceral provoca um fenômeno de sensibilização dessas estruturas somáticas superficiais, que resulta em hiperalgesia. Demonstra-se claramente, nesses pacientes, a ocorrência de maior sensibilidade à dor cutânea e, em especial, a existência de dor miofascial nos músculos do mesmo segmento espinal.
As dores viscerais frequentemente são descritas como de intensidade variável, como em onda, com períodos de piora, seguidos de melhora. Outro fenômeno característico das dores viscerais é a associação mais exuberante com fenômenos neurovegetativos, tais com o palidez, mal-estar, sudorese e aumento do peristaltismo.
Ocasionalmente, uma doença que acomete uma víscera pode se alastrar, passando a acometer nervos somáticos (p. ex., na pleura e no peritônio). Quando isso ocorre, a dor, antes difusa, pode se tornar mais localizada.
Tal fato provavelmente se explique pela existência de nociceptores silentes, os quais não manifestam atividade em situações normais, mas seriam ativados pela presença de substâncias químicas liberadas na região afetada quando ocorre sensibilização.
Conforme já se disse, a distensão mecânica nas vísceras ocas produz dor. Uma segunda causa de geração de dor visceral ocorre nos processos inflamatórios. Provavelmente, o mecanismo de geração de dor se deva à liberação de substâncias algogênicas, das quais a mais estudada é a bradicinina.
Há muito se sabe que as vísceras apresentam receptores (aferentes) que se projetam ao sistema nervoso central através do sistema nervoso simpático e parassimpático. Alguns desses aferentes possuem função apenas regulatória (autonômica) enquanto outros geram respostas sensitivas, particularmente de dor. Esses aferentes são formados por fibras nervosas finas que podem ser pouco mielinizadas (Adelta) ou amielinizadas (fibras C).
Uma questão ainda não resolvida diz respeito à existência de aferentes puramente dolorosos para determinado estímulo (específicos) ou se tais fibras teriam função mista (regulatória e sensitiva), passando a responder de uma forma ou outra de acordo com a intensidade do estímulo (teoria do padrão e intensidade).
A maior parte das fibras aferentes viscerais, antes de se dirigirem à medula espinal, trafegam para gânglios simpáticos pré-vertebrais e paravertebrais. Os gânglios pré-vertebrais são representados pelos gânglios celíaco e mesentéricos superior e inferior. Os gânglios paravertebrais são representados pelos gânglios cervicais superior, médio e inferior, gânglio estrelado, gânglios toracolombares, gânglio sacral e gânglio ímpar coccígeo (gânglio de Walther). Uma pequena parte dos estímulos dolorosos, no entanto, trafega por nervos do sistema nervoso parassimpático.
Enquanto as fibras aferentes somáticas são numerosas e penetram na medula espinal em determinado segmento, as fibras aferentes viscerais são poucas e penetram no corno posterior da medula espinal em vários níveis, o que justifica a pouca localização espacial dessas dores. Na medula espinal, as fibras se dirigem especialmente à lâmina superficial (lâmina I de Rexed) e a outras mais profundas (V e X). Daí os estímulos são transmitidos pelas mesmas vias da dor superficial. Mais comumente, cruzam a linha média e ascendem pelo trato espinotalâmico lateral até os núcleos ventrais do tálamo e daí ao córtex cerebral. Outras vias, tais com o a espinorreticular e a espinomesencefálica, devem ter papel importante em fenômenos associados, tais como o alerta à dor e aos fenômenos neurovegetativos que o acompanham.
- A Transmissão da Dor Visceral
O impulso sensorial dos 2/3 superiores do esôfago é transmitido por fibras A-delta e C no vago e do 1/3 inferior por fibras simpáticas, que vão de T-5 a T-8. O estômago e os intestinos delgado e grosso até o ângulo esplênico são supridos por fibras simpáticas de T-6 a L-2. As fibras que inervam o cólon descendente e reto passam através do nervo pélvico e penetram na medula espinhal, por via ventral e dorsal, associadas às raízes de S2-S4.
Os receptores mecânicos ou mecanorreceptores existentes na musculatura lisa de todas as vísceras ocas são do tipo A delta e C, e respondem a estímulos mecânicos leves, tensão aplicada ao peritônio, contração e distensão da musculatura lisa.
O trato gastrintestinal possui receptores químicos e mecânicos de adaptação lenta e rápida que são classificados em dois grupos: o grupo de receptores de alto limiar para estímulos mecânicos leves, e o grupo de baixo limiar para estímulos mecânicos que responde a estímulos agressivos e não agressivos. O primeiro grupo é encontrado no esôfago, sistema biliar, intestino delgado e cólon e o segundo, apenas, no esôfago e cólon. A relação entre a intensidade do estímulo e a atividade nervosa é somente evocada após a estimulação nociva.
As estimulações viscerais, tais como hipóxia e inflamação tissular, resultam em sensibilização de receptores de alto limiar e de nociceptores silenciosos previamente não-responsivos os quais perfazem 40% a 45% da inervação visceral aferente do cólon. Estes nociceptores contribuem para a tradução do sinal na dor visceral crônica, alterações prolongadas dos reflexos espinhais e da regulação autonômica anormal dos órgãos internos. A sensibilização desses receptores persiste mesmo após a cessação do estímulo nociceptivo, traduzida por alterações das funções motora e sensitiva (hiperalgesia visceral). Assim, estímulos fisiológicos como comer e beber são traduzidos e amplificados de forma inadequada, provocando uma descarga periférica exagerada, que é interpretada no SNC como dolorosa. Isso sugere que nociceptores silenciosos ativados podem favorecer a iniciação e manutenção da hiperalgesia visceral por mecanismos centrais e periféricos. Além disso, dano e inflamação da víscera afetam a fisiologia habitual de motilidade e secreção, produzindo mudanças dramáticas em torno do ambiente que circunda as terminações nervosas nociceptivas. Dessa forma, pode haver excitação de nociceptores distantes do local inicial da agressão.
- Vias
As vias para a sensação visceral são difusamente organizadas tanto periférica como centralmente. As fibras nervosas primárias aferentes inervam as projeções viscerais para o sistema nervoso central através de três vias:
- Nervo vago e seus ramos,
- No interior e ao longo das vias eferentes das fibras simpáticas (cadeia simpática e ramos esplâncnicos, incluindo maior, menor, mínimo, torácicos e lombares)
- No nervo pélvico (com eferentes parassimpáticos) e as suas ramificações.
A passagem através dos gânglios periféricos ocorre com potencial contato sináptico (por exemplo, nervos dos plexos celíaco, mesentérico superior e hipogástrico). O trato gastrointestinal e os gânglios periféricos formam extensos plexos neuronais que controlam as funções autonómicas. O seu papel na sensação de dor é desconhecido. Os corpos celulares dos aferentes primários que viajam para o sistema nervoso central residem principalmente no gânglio nodoso (vagal) e no T2-L2 e nos gânglios da raiz dorsal S1-5 (simpático-associado e nervo- pélvico associado). Os aferentes vagais podem desempenhar um papel na sensibilidade nociceptiva. Alguns aferentes espinais, mas não todos, estão inequivocamente associadas à sensação de dor. Demonstrou-se que os aferentes viscerais primários entram na medula espinal e a arborizam extensivamente, inclusivamente no trato Lissauer, para penetrar vários segmentos espinais, acima e abaixo do segmento de entrada. Estes aferentes estabelecem contato sináptico, com ambos os neurónios superficiais e profundos do corno dorsal ipsilateral e contralateral ao lado da entrada. O resultado é a ativação ampla e difusa do sistema nervoso central.
O processamento de estímulos viscerais de segunda ordem ocorre em segmentos espinais e em locais do tronco cerebral que recebem entrada do aferente primário. Os neurónios do corno dorsal espinhal que respondem a estímulos viscerais que causam dor têm sido amplamente estudados. Ocorre o processamento nociceptivo intraespinal, bem como a transmissão para outros locais do sistema nervoso central. A informação nociceptiva visceral viaja por ambas as vias, espinotalâmicas tradicionais (o quadrante contralateral ventrolateral), e vias ipsilaterais dorsais e vias dorsais espinais. Os locais de transmissão da informação ascendente foram identificados ao nível da medula, ponte, mesencéfalo e tálamo. O processamento cortical da informação visceral tem sido observado no córtex insular, córtex cingulado anterior e córtex somatossensorial.
- Dor visceral em quadrantes
A dor na região epigástrica ocorre por lesões no estômago, vesícula biliar, duodeno, pâncreas, fígado, região distal do esôfago, coração e pulmões, principalmente por úlcera péptica, úlcera perfurada, gastrites, espasmo pilórico, carcinoma gástrico, pancreatite crônica ou aguda, colecistite, litíase biliar, perfuração do esôfago na porção inferior, esofagite química ou bacteriana, infarto do miocárdio, pericardite, insuficiência cardíaca congestiva ou hérnia epigástrica. A dor visceral de origem no estômago localiza-se habitualmente na região médio-epigástrica.
A dor no hipocôndrio direito ocorre por afecções do fígado, vesícula biliar, flexura hepática do cólon, distúrbios no hemitórax direito, hemidiafrágma direito, doenças musculoesqueléticas ou do sistema nervoso. As lesões mais frequentes são a colecistite crônica ou aguda, cólica biliar, câncer hepático e do sistema biliar, abscesso hepático e pancreático, hepatite crônica ou aguda, pleurisia hemidiafragmática direita, abscesso subfrênico, úlcera duodenal, neuralgia intercostal, síndrome pós-colecistectomia e pneumonia. A dor hepática localiza-se no hipocôndrio direito, epigástrio, ou na região torácica distal, intensifica-se às expirações e pode ser referida no ombro e escápula direita.
A dor no hipocôndrio esquerdo ocorre por afecções do baço, flexura esplênica do cólon, lesão do hemitórax esquerdo, cauda do pâncreas, doenças neurológicas e musculoesqueléticas. O tromboembolismo ou trombose dos nervos esplênicos, o infarto esplênico, o abscesso esplênico, a esplenomegalia, a colite, a ruptura de baço, o carcinoma de flexura esplênica do cólon, a pneumonia, a neuralgia intercostal, a hérnia diafragmática, a pericardite e a angina pectoris, são as lesões mais frequentes. A dor visceral pancreática caracteriza-se por desconforto abdominal constante, com irradiação para regiões lombar ou dorsal distal.
A dor lombar ocorre por lesão dos rins, ureteres, cabeça e cauda do pâncreas ou cólon. As causas principais são os abscessos perirrenal, a pielite, a pielonefrite, abscessos renais, tumor renal, tuberculose renal, síndrome dolorosa pós-nefrectomia, neuralgia intercostal de um ou mais nervos (T8-T11) compressão radicular por tumor, doenças vertebrais e herpes-zóster.
A dor na região periumbilical ocorre por lesão do intestino delgado, apêndice, ceco, corpo do pâncreas, afecções musculoesqueléticas ou neurológicas, principalmente por obstrução intestinal aguda, diverticulite de Meckel, tromboembolismo da artéria mesentérica superior, enterocolite, hérnia umbilical, neuralgia intercostal (T9-T11) ou síndrome dolorosa miofascial.
A dor na região ilíaca direita ocorre por lesões do apêndice, intestino delgado, ceco, rim e ureter direito, tuba uterina direita ou ovário direito, afecções musculoesqueléticas ou neurológicas, tais como: apendicite aguda, salpingite crônica, ruptura de folículo ovariano, cólica renal, pielite aguda, carcinoma do ceco, hérnia inguinal, epididimite aguda e psoíte.
A dor na região ilíaca esquerda ocorre devido a lesões do cólon sigmoide, trato urinário esquerdo, genitália feminina interna, afecções musculoesqueléticas ou neurológicas. São causas comuns a salpingite aguda, gravidez ectópica, colite ulcerativa, psoíte, diverticulite, volvo do sigmóide, intussuscepção intestinal, obstrução intestinal, hérnia inguinal, epididimite, neuropatia segmentar (herpes-zóster, hérnia de disco, tumor medular), neuralgias dos nervos íleo-hipogástrico ou íleo-inguinal e a síndrome dolorosa miofascial lombar.
A dor no hipogástrio ocorre devido a lesões da bexiga, genitália interna, doenças intestinais, afecções musculoesqueléticas ou neurológicas. A cistite aguda, distensão vesical (bexigoma), prostatite, hipertrofia prostática, carcinoma de bexiga, tumor no retossigmóide, constipação crônica e doenças da genitália feminina interna são as causas mais frequentes.
REFERÊNCIAS BIBLIOGRÁFICAS
- LENT, Roberto. Cem bilhões de neurônios. ed. São Paulo: Atheneu, 2010.
- BEAR, Mark F.; CONNORS, Barry W.; PARADISO, Michael A.. Neurociências: desvendando o sistema 3. ed. Porto Alegre: Artmed, 2008.
- Kraychete Durval Campos, Guimarães Ana Cristina. Hiperalgesia visceral e dor abdominal crônica: abordagem diagnóstica e terapêutica. Rev. Bras. Anestesiol. [Internet]. 2003 Dec [cited 2017 Sep 02] ; 53( 6 ): 833-853.
- Neurobiologia da Dor Visceral. Ano Global Contra a Dor. IASP.
- NETO ALVES, Onofre; JACOBSEN, Manoel Teixeira; DE SIQUEIRA, José Tadeu; COSTA, Carlos Maurício de Castro. Dor: Princípios e Prática. Editora Artmed AS, 2009.
Resumo: Fibromialgia e Síndrome Miofascial
- Fibromialgia: condição dolorosa crônica difusa do sistema musculoesquelético, não-articular. Presença de dor à palpação em locais denominados tender points.
- Fisiopatologia
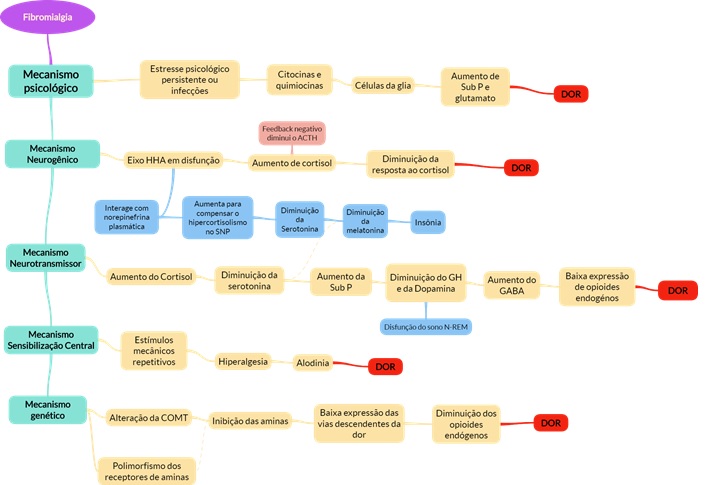
- Sinais e sintomas: Dor musculoesquelética crônica (mais de 3 meses), hipersensibilidade mecânica, insônia, fadiga, cefaleia, síndrome das pernas inquietas, síndrome do intestino irritável, fotossensibilidade, cãibras nos MMII e perda de memória. A dor possui início gradual ou pós-traumático; costuma ser persistente, difusa, profunda e latejante.
- Diagnóstico: avaliação da história clínica, dor a palpação digital dos tender points (no mínimo, 11).
- Tratamento farmacológico: antidepressivos, miorrelaxantes, analgésicos, anticonvulsivantes.
- Tratamento não-farmacológico: fisioterapia, yoga, meditação, terapia psicológica, acupuntura, massoterapia.
- Patologias associadas a fibromialgia: hipotireoidismo, lúpus eritematoso sistêmico, artrite reumatoide.
- Síndrome Miofascial
- Caracterizada por múltiplas áreas de dor (trigger points) e hipersensibilidade. Descrita como profunda, contínua e em queimação. Acomete, principalmente, a parte posterior do pescoço, a região lombossacra, ombros e tórax.
- Quanto o trigger point é pressionado causa uma dor referida.
- Fisiopatologia:
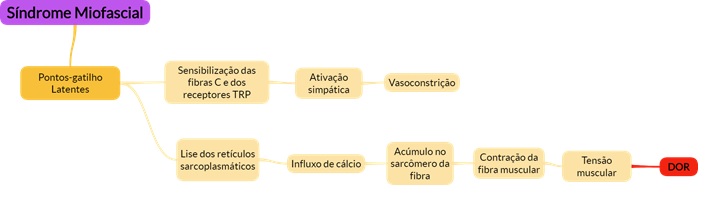
- Quadro clínico: dor difusa muscular em queimação, latejamento, parestesia, limitação da amplitude de movimento, diminuição da força muscular.
- Diagnóstico: Análise da história clínica, avaliação da amplitude de movimento, avaliação dos triggers points.
- Tratamento farmacológico: analgésicos, anti-inflamatórios, antidepressivos, miorrelaxantes.
- Tratamento não farmacológico: crioterapia, eletroterapia, compressas quentes, ultrassom, toxina botulínica, acupuntura, infiltração com lidocaína.
- Diagnóstico Diferencial entre SDM e FM
|
|
Síndrome Miofascial | Fibromialgia |
| Definição | Disfunção primária localizada em músculos específicos. | Doença sistêmica; anormalidade na modulação da dor; afeta músculos e outros tecidos. |
| Sexo | Incidência igual | Mais frequente no sexo feminino |
| Localização | Localizada ou segmentar | Generalizada e simétrica |
| Dor referida | Espontânea | Sem dor referida |
| Idade | Sem predominância | 40 a 60 anos |
| Espasmo muscular | Presente | Não está presente |
| Fraqueza | Comum | Incomum |
- Opioides
- Os opióides atuam a nível celular ligando-se aos receptores opióides presentes em todo o sistema nervoso central. Os receptores opióides são ligados às proteínas G inibitórias. A ativação dessa proteína desencadeia fechamento de canais de cálcio voltagem dependentes e estímulo ao efluxo de potássio resultando em hiperpolarização celular. O efeito final é a redução da excitabilidade neuronal, resultando em redução da neurotransmissão de impulsos nociceptivos.
- Efeitos adversos: Sedação, sonolência, náusea e vômito, constipação e depressão respiratória, alucinação, pesadelo, retenção urinária, obstipação, mioclonia, disforia, hiperalgesia.
- Tricíclicos
- Os antidepressivos tricíclicos em nível pré-sináptico é o bloqueio de recaptura de monoaminas, principalmente norepinefrina (NE) e serotonina (5HT) e em menor proporção, de dopamina (DA).
- Efeitos adversos: xerostomia, sonolência, tontura, alteração do paladar, ganho de peso, aumento do apetite, cefaleia.
- Anestésicos locais
- Bloqueiam a ação de canais iônicos na membrana celular neuronal, impedindo a neurotransmissão do potencial de ação. A forma ionizada do anestésico local se liga de modo especifico aos canais de sódio, inativando-os e impedindo a propagação da despolarização celular.
- Efeitos adversos: Parestesia nos lábios, dificuldade na articulação das palavras, redução do nível de consciência e convulsões.
Referências Bibliográficas
- NETO ALVES, Onofre; JACOBSEN, Manoel Teixeira; DE SIQUEIRA, José Tadeu; COSTA, Carlos Maurício de Castro. Dor: Princípios e Prática. Editora Artmed AS, 2009. Cap39.
- VON ROENN, Jamie H.; PAICE, Judith A.; PREODOR, Michael E. Current Diagnóstico e Tratamento da Dor. Rio de Janeiro: Mcgraw-hill Companies, 2008.
- IASP (International Association for the Study of Pain).
- Reumatologia de Harrison / Anthony S. Fauci, Carol A. Langford – 3. ed. –– Porto Alegre: AMGH, 2014.
- Reumatologia: diagnóstico e tratamento / organizadores Marco Antonio P. Carvalho– 4. ed. – São Paulo: AC Farmacêutica, 2014.
- Clínica médica, volume 5: doenças endócrinas e metabólicas, doenças ósseas, doenças reumatológicas. – Barueri, SP: Manole, 2009. – (Clínica médica).
- Fukuda CT, Takarada GH, Skare TL. Estudo comparativo entre fibromialgia primária e secundária. Rev. Med. Res. 2010; 12 (3 e 4): 111-117.
- SCOTTON, Antônio Scafuto et al. Como Diagnosticar e Tratar Fibromialgia. [S.l.: s.n.], 2010. 221 à 227 p. Disponível em: <http://www.moreirajr.com.br/revistas.asp?fase=r003&id_materia=4324>. Acesso em: 22 ago. 2017.
- Kaziyama, H.H.S., Lin, T.Y., Teixeira, M.J., Piagge, F.D. Síndrome fibromiálgica. Rev. Med. (São Paulo), 80(ed. esp. pt.1):111-27, 2001.
- MORENO, Ricardo Alberto; MORENO, Doris Hupfeld; SOARES, Márcia Britto de Macedo. Psicofarmacologia de antidepressivos. Bras. Psiquiatr., São Paulo , v. 21, supl. 1, p. 24-40, May 1999.
- Sociedade Brasileira de Anestesiologia. Farmacologia dos opióides.
- Sociedade brasileira de anestesiologia. Farmacologia dos anestésicos locais.
Dor Neuropática: Resumo
- Dor neuropática
- Devida a lesão primária do SNP ou do SNC.
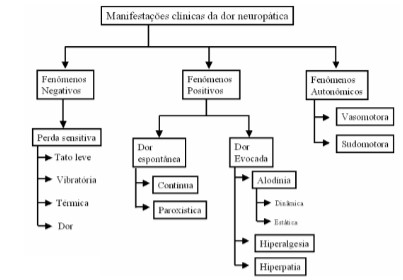
- O conceito mais amplo de dor neuropática inclui dor que persiste além da dor; presença de fenômenos sensitivos; e presença de fenômenos motores e autonômicos.
- Classificação
- Central (vascular, desmielinizante, traumática, tumoral, degenerativa) e periférica (amputação, neuralgias, lesão de plexo).
- Dor espontânea: sem estímulo. Constante (queimação, dormência, parestesia) ou intermitente (choque).
- Dor evocada: com estímulo térmico, mecânico ou químico.
- Alodinia: não é constante, estímulo não-doloroso causa dor.
- Hiperalgesia: pequeno estímulo causa dor exagerada.
- Manifestações clínicas: perda sensitiva (tato leve, vibratória, térmica, dor), sudorese, alterações vasomotoras.
- Diagnóstico: realizar a análise da dor, analisar a presença de formigamento, dormência. Procurar por descritores como “queimando”, “pulsando”, “descarga elétrica”, “lancinante”, “em facada”, “prurido”.
- Exame neurológico: identificação da dor; avaliação de sensibilidade dolorosa, pressão, temperatura, vibração e tato discriminativo.
- Avaliar motricidade e reflexos.
- Eletroneuromiografia: avaliação de fibras mielinizadas afetadas.
- Ressonância magnética: avaliar lesões de estruturas do SNC.
- Tratamento: anticonvulsivantes, antidepressivos, opióides, antagonistas de NMDA, anestésicos, etc.
- Mecanismo
- Síndrome Complexa da Dor Regional
- Caracteriza-se pela presença de dor espontânea em queimação, com edema e alteração da função motora.
- Tipo 1: Causada por traumas ou fraturas pequenas, sem lesão de nervo detectável.
- Tipo 2: Apresenta lesão nervosa.
- Sintomas: fraqueza, distonias, espasmos musculares, tremores, dificuldade de movimentação do membro, sudorese, estresse emocional.
- Gabapentina
- Reduz liberação sináptica de neurotransmissores e diminui o influxo pós-sináptico de cálcio, diminuindo a hiperexcitabilidade.
- Indicado para dor neuropática e para terapis de crises epiléticas.
- Efeitos adversos: mal estar, fadiga, febre, cefaleia, edema, palpitação, xerostomia, confusão mental, impotência.
- Dor Fantasma
- Sensação da existência da região amputada. Acomete 60-80% dos pacientes. Geralmente descrita como “penetrante, pruriginosa e em queimação”.
- Dor no coto: formação de neuroma no local de secção do nervo, com isquemia ou inflamação.
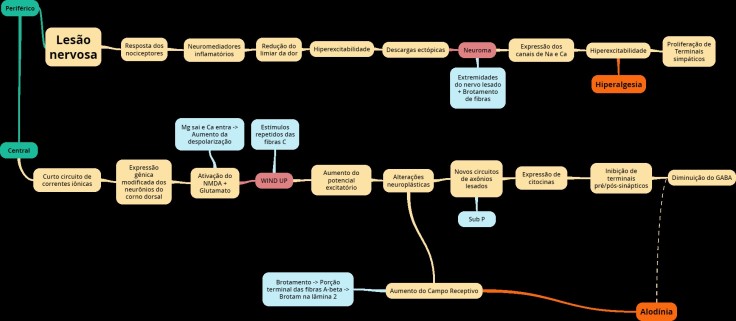
- Mecanismo periférico da dor
- Amputação à Nervos periféricos seccionados à Destruição do tecido neuronal à Rotura da aferência do nervo para a medula espinal à Desaferenciação à Porção proximal dos nervos à Formam neuromas.
- Mecanismo central da dor
- Sensibilização central à Aumento da atividade neuronal à Aumento do campo receptivo à Hiperexcitabilidade à Aumento de receptores NMDA + Sub P à Reorganização anatômica à Lesão degenera fibras C à Fibras A-beta tomam o lugar à Estímulos não dolorosos causam dor à Áreas corticais da região são assumidas por zonas vizinhas.
- Sensibilização periférica
- Evento que acompanha o processo inflamatório e implica mudança do limiar de ativação dos nociceptores na lesão.
- Agressão à Lesão à Liberação de prostaglandinas, sub P, histamina à Resposta inflamatória à Nociceptores à Inflamação à COX à Fosforilação dos canais de Na à Diminuição do limiar de excitação à Hiperexcitabilidade à Sensibilização periférica à
- Sensibilização central
- Sensibilização periférica persistente à Sensibilização central à SNC à Liberação de Sub P e Glutamato à Receptores NMDA à Aumento da despolarização à Fibras A-delta e C à Corno dorsal à Diminuição do limiar à Estímulos não dolorosos causam dor à
- Wind up
- É definido como a somação de potenciais pós-sinápticos em rápida sucessão deflagrados pelo mesmo neurônio.
- Sensibilização central à Alterações plásticas de neurônios na coluna dorsal à Estímulos de alta frequência à Glutamato à Aumento do potencial excitatório à Estímulo fibras C à Wind up.
Referências Bibliográficas
- ALVES NETO, Onofre. Dor: Princípios e Prática. Porto Alegre: Editora Artmed, 2009.
- Universidade do Porto. Dor no amputado. 2012.
- Revista de Neurociências. Revisão Sistemática sobre tratamento Medicamentoso para Dor no Membro Fantasma.
- Chamlian TR, Bonilha MMM, Macêdo MCM, Rezende F, Leal CAP Prevalência de dor fantasma em amputados do Lar Escola São Francisco.
- Sociedade de Anestesiologia do Estado do Rio de Janeiro. Livro – Dor. 2003.
- KANDEL, Eric R. et al. Princípios de Neurociências. 5. ed. Porto Alegre: Amgh Editora Ltda, 2014.
- Interação entre limiar de dor e função autonômica após restrição de sono em individuos saudáveis. Letizzia Dall’ Agnol. UFGRS, 2011.
- Departamento de Fisiologia, Unesp – Botucatu. Mecanismos de comunicação entre os neurônios e dos neurônios com os órgãos efetuadores.
- Revista Brasileira de Anestesiologia. Dor: aspectos atuais da sensibilização periférica e central.
- Síndrome Dolorosa Complexa Regional: Epidemiologia, Fisiopatologia, Manifestações Clínicas, Testes Diagnósticos e Propostas Terapêuticas; Revista Brasileira de Anestesiologia – Vol. 52, Nº 5, setembro – outubro, 2002- Francisco Carlos Obata Cordon, Lino Lemonica TSA.
- A dor e o controle do sofrimento – Revista de Psicofisiologia, 1(1), 1997 – UFMG.
- MATHEUS, Maria Eline. Antidepressivos Tricíclicos e Gabapentinóides: uma análise do perfil farmacológico no tratamento da dor neuropática. 2012.
- Universidade Federal de Alagoas, Eliane Aparecida Campesatto; Camila Emily Batista Sales Marques. Uso de gabapentina no tratamento da dor neuropática e do topiramato na enxaqueca.
- GOLDMAN L., AUSIELLO D. Cecil: Medicina. 23ª ed. Rio de Janeiro: Elsevier, 2009. Vol I e II.
Dor neuropática
-
Explicar os mecanismos de dor neuropática e suas manifestações clinicas.
Dor neuropática: devida à lesão primária do sistema nervoso periférico ou central.
Características
- Dor e sintomas sensitivos que persistam além do período de cura.
- Presença de fenômenos sensitivos negativos e positivos.
- Presença também de fenômenos motores positivos e negativos e de fenômenos autonômicos.
A identificação da condição de dor neuropática constitui se em um dos desafios na clínica diária de dor, notadamente pela:
- Ausência de sinais e sintomas patognomônicos.
- Indefinição de correlação entre sintomas, sinais e mecanismos fisiopatogênicos.
- Possível neuroplasticidade variável do sistema nervoso periférico e central.
- Eficiência parcial e limitada das intervenções terapêuticas farmacológicas e não-farmacológicas que permitam inferir deduções fisiopatológicas.

Mecanismos da Dor Neuropática
- Mecanismos periféricos
1. Sensibilização periférica
Vinculada a uma resposta aumentada dos terminais dos nociceptores, decorrente de ação de neuromediadores inflamatórios, o que dá origem a alodinea e hiperalgesia. Isso é consequência, a nível de nociceptores, da diminuição do limiar, indução de descargas ectópicas e aumento na quantidade de canais de sódio.
Esse mecanismo é diretamente vinculado à dor nociceptiva inflamatória, porém, em lesões traumáticas, terminais nervosos são geralmente comprometidos, o que produz um a sobreposição de mecanismos inflamatórios e neuropáticos, consequentes à degeneração walleriana do nervo.
- Descargas ectópicas
Constituídas de impulsos elétricos anormais espontâneos evocados e repetitivos a partir de locais incomuns e diferentes das terminações nervosas.
As fontes incomuns das descargas ectópicas são constituídas de neuromas, axônios desmielinizados por trauma, processos autoimunes, aferentes adjacentes intactos e gânglios da raiz dorsal.
O neuroma é formado no coto proximal do axônio seccionado ou traumatizado por brotamento de novas fibras, e a atividade ectópica é originada em fibras mielinizadas (A) e amielinizadas (C). Focos de desmielinização em fibras danificadas por traumatismos são também fontes de atividade ectópica por brotamento de fibras. Outras fontes de descargas ectópicas são aferentes residuais intactos expostos aos produtos de degeneração e mediadores inflamatórios e corpos neuronais do gânglio da raiz dorsal.
As expressões comportamentais de atividade ectópica em animais são autotomia e comportamentos autodirigidos (lamber-se, vibrar as patas posteriores e morder-se). Clinicamente, em humanos, são a base do sinal de Tinel.
- Acoplamento simpático-sensitivo
É uma expressão especial de quimiossensibilidade ectópica e reflete um a sensibilidade elevada de neurônios sensitivos devido à maior expressão de adrenorreceptores na membrana neuronal, ao lado de proliferação de terminais simpáticos.
- Excitação cruzada efática
É o processo fisiopatológico pelo qual, a partir de fibra nervosa danificada, há o desenvolvimento de curto-circuito elétrico p o r correntes iônicas com fibras nervosas adjacentes intactas. Outro fenômeno relacionado é a excitação cruzada “não-efática” por mediadores químicos difusíveis, o que pode ser a base da explicação do ticdouloureux na neuralgia do trigêmeo.
- Alterações fenotípicas
Por expressão gênica modificada de neurônios do gânglio da raiz dorsal e de neurônios do corno dorsal da medula constituem importantes mecanismos de dor neuropática. Os genes modificados após axotomia aqui descritos envolvem os relacionados a neuropeptídios, receptores, canais iônicos, enzimas, transmissão sináptica, proteínas de crescimento, citoesqueleto e mobilidade celular, metabolismo e outros.
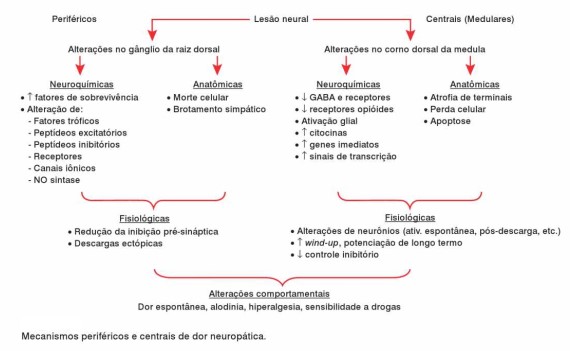
Os mecanismos centrais medulares de dor neuropática são consequentes a lesões periféricas ou centrais e se expressam pelo desenvolvimento de sensibilização central, alterações neuroplásticas e redução ou perda de controle inibitório.
A sensibilização central é resultado de ativação do receptor NMDA, aumento do conteúdo de glutamato, aspartato e cálcio intracelular, além de ativação também de receptores AM PA e receptores metabotrópicos de glutamato.
Os mecanismos centrais medulares de dor neuropática são consequentes a lesões periféricas ou centrais e se expressam pelo desenvolvimento de sensibilização central, alterações neuroplásticas e redução ou perda de controle inibitório.
A sensibilização central é resultado de ativação do receptor NMDA , aumento do conteúdo de glutamato, aspartato e cálcio intracelular, além de ativação também de receptores AMPA e receptores metabotrópicos de glutamato.
- Mecanismos Centrais Encefálicos
A dor central ou encefálica/medular é um a condição decorrente de lesão ou disfunção no sistema nervoso central. As causas mais com uns, com o vimos na seção sobre aspectos clínicos, são doença cerebrovascular, esclerose múltipla e traumatismo medular, com incidências respectivas de 8, 28 e 30%.
Os mecanismos de dor central encefálica e medular são variados tanto em expressão com o em dimensão lesional, porém há elementos que serão aqui explicitados, os quais sumariam ente são:
- Desinibição das vias lemniscais mediais e espinotalâmicas.
- Ruptura da integração termossensitiva e perda da inibição pelo frio de dor em queimação.
- Retirada da inibição do núcleo reticular talâmico e aumento da atividade neuronal oscilatória no tálamo.
- Lesão no núcleo ventroposterior e dorsomedial talâmico.
- Mecanismos corticais parietais.
- Memória da dor e potenciação de longo prazo.
Em resumo, a dor central encefálica repousa fundamentalmente em mecanismos talâmicos resultantes de atividade e reatividade neuronais aumentadas ao longo das vias somatossensoriais e de decréscimo dos mecanismos inibitórios, envolvendo aminoácidos excitatórios e receptores NMDA.
Clinicamente, o resultado dessas lesões é expresso por hipoestesia, hiperestesia, parestesias e disestesias, dor irradiada, latência prolongada de resposta, pós-sensações e som ação temporal, as quais podem configurar a hiperpatia.
-
Caracterizar dor fantasma como exemplo de dor neuropática
A dor do membro fantasma é parte de um complexo de sintomas da amputação. Existe o fenômeno fantasma que é a sensação da existência da região amputada, sem que o paciente dor. Em relação a dor fantasma, ocorre em área do corpo que foi amputada, embora seja mais comum após amputação de membro.
A incidência do fenômeno e da dor fantasma aumenta com a idade, sendo mais frequente no membro dominante e é mais intensa em amputações proximais. A frequência da dor fantasma é de 60 a 85% dos pacientes que tiveram algum membro amputado.
A incidência da dor é maior logo após a amputação, diminuindo com o tempo. O surgimento é mais frequente imediatamente após a amputação, mas pode surgir até um ano após e geralmente desaparece em 2 a 3 anos. A sensação mais intensa corresponde a regiões do corpo com maior representação cortical.
Ela tem como característica ser intermitente ou constante em alguns pacientes, estar situada predominantemente na parte distal e ser descrita como penetrante, pruriginosa e em queimação. O membro fantasma é extremamente real para o paciente, de maneira que este pode tentar pegar um objeto com a mão fantasma ou tentar apoiar-se sobre uma perna fantasma.
Fatores predisponentes a essa síndrome incluem dor pré-operatória, fatores genéticos e condições psicológicas, assim como o impacto sobre a vida econômica e social trazido pela amputação. Além da idade avançada e existência de dor antes da amputação. O membro fantasma raramente ocorre após amputação de membro em crianças pequenas.
Os mecanismos que a ela conduzem centram-se em alterações neuronais que levam a hiperexcitabilidade e neuroplasticidade, razão pela qual o tratamento se baseia em uso local (lidocaína tópica), anticonvulsivantes, antidepressivos tricíclicos, opióides ou tramadol. A colocação precoce de prótese também pode ter efeito benéfico.
A dor que ocorre no coto surge, geralmente, em decorrência da formação de neuroma no local de secção do nervo, mas pode ser provocada por isquemia ou infecção do local. É um fator para aumentar a incidência da dor fantasma.
- Fisiopatologia:
Por muito tempo, a dor fantasma era considerada uma doença psiquiátrica, mas, com o tempo mecanismos periféricos e centrais entraram nas hipóteses que ganharam consenso como causa da dor. Porém, nenhuma das construções teóricas até hoje parecem ser capazes de explicar o fenômeno da dor fantasma de forma independente, podendo coexistir múltiplos mecanismos.
- Mecanismos periféricos
Quando ocorre a amputação, os nervos periféricos são seccionados e isso leva a uma destruição do tecido neuronal, causando rotura do padrão normal de aferência do nervo para a medula espinhal. Após isso, ocorre um processo de desaferenciação e a porção proximal dos nervos seccionados pode formar neuromas.
Ocorre aumento da acumulação de moléculas que reforçam a expressão de canais de sódio nestes neuromas, que resulta em hiperexcitabilidade e descargas espontâneas. Assim, em geral, há um aumento na atividade ectópica e uma perda de controle inibitório no corno dorsal.
Essa teoria se confirma quando estudos relatam a redução da dor fantasma com o uso de fármacos bloqueadores dos canais de sódio.
- Mecanismos neurais centrais
- Alterações ao nível da medula
Ocorre um processo chamado de sensibilização central e consiste em regiões axonais na seção proximais do nervo periférico amputado formam conexões nervosas com neurônios do campo receptivo da medula espinhal. Alguns neurônios nas áreas da medula que não são responsáveis pela transmissão da dor, também podem “germinar” na lamina II do corno dorsal da espinal medula, que é a área envolvida na transmissão de entradas aferentes nociceptivas. Isso é seguido pela atividade neuronal aumentada, expansão do campo neuronal receptivo e hiperexcitabilidade de outras regiões.
Durante o processo de sensibilização central, existe também um aumento da atividade dos receptores NMDA, mediados por neurotransmissores, tais como a substancia P, taquiquininas e neuroquininas, no corno dorsal da medula espinal.
- Reorganização anatômica
Após a lesão do nervo, as fibras-C não mielinizadas envolvidas na condução da dor normalmente fazem sinapses na lamina 1 e 2 do corno dorsal. A lesão do nervo periférico pode levar a degeneração destas fibras-C. As grandes fibras mielinizadas AB-fibras, que, normalmente, estão envolvidas no tato, pressão e propriocepção, enviam conexões a partir das laminas 3 e 4. Isso pode contribuir para o desenvolvimento da dor do membro fantasma, onde estímulos não dolorosos podem ser experenciados como dolorosos.
- Alterações ao nível do cérebro
Durante a reorganização, as áreas corticais representando a extremidade amputada são assumidas pelas zonas de representação vizinhas, tanto no córtex somatossensorial primário como no córtex motor.
A reorganização cortical em parte explica por que a estimulação aferente nociceptiva dos neurônios dentro do coto ou área circundante produz a sensação no membro ausente.
Em membros superiores amputados, a área do córtex somatossensorial correspondente ao membro perdido aparece para receber informações sensoriais de outras áreas do corpo que fazem sinapse em áreas adjacentes no córtex somatossensorial.
O `homúnculo’ Penfield mostra que a área da face faz fronteira com a área da mão. Muitas vezes, nos amputados de membros superiores, quando se toca no rosto, experienciam simultaneamente uma sensação de toque na cara e ao longo dos dígitos amputados. A velocidade com que estas alterações ocorrerem após amputação de membros sugere que está reorganização é provável que seja um resultado de desmascaramento das sinapses ocultas no córtex somatossensorial, em vez de alterações anatómicas diretas.
As mudanças neuroplásticas envolvem tanto a perda imediata de entradas inibitórias de uma região para outra, como o surgimento de novas conexões durante longos períodos de tempo. A reorganização de mapas do corpo é evidente noutras condições mal adaptativas de dor, tais como a síndrome da dor regional complexa (SDRC), ou na sequência de uma aplasia congénita do membro, em que há uma mudança funcional dos membros que se formaram (por exemplo, quando os pés e os dedos são usados para escrever e gesticular.
As mudanças plásticas podem corresponder à experiência de sensações referidas, que podem ser desencadeadas por estímulos externos, especialmente se a parte do corpo estimulada não pode ser vista. Isto implica que as sensações referidas são menos frequentes quando a estimulação é re-aferente (isto é, correspondente a sinais sensoriais resultantes, e prevê, a partir de auto-acções), ou pode ser aumentada pela entrada visual. A ausência de feedback visual e proprioceptivo válido, para corroborar a cópia eferente de comandos motores dirigidos ao membro fantasma, foi relacionado com o surgimento da DFa.
A DFa nos membros pode surgir a partir de erros que ocorrem neste processo de remapeamento cortical, levando à amplificação excessiva da dor experienciada. Também podem ocorrer erros nas modalidades sensoriais, com o toque a ser experimentado como dor.
A extensão da reorganização cortical, está diretamente relacionada com o grau de dor e com o tamanho da região desaferenciada. Vários estudos de imagem têm correlacionado maior grau de envolvimento do córtex somatossensorial com experiência de mais dor membro fantasma intensa.
A outra hipótese em relação ao mecanismo da DFa, surgiu a partir da pesquisa em percepções ilusórias. Demonstrou-se que além do córtex somatossensorial primário, ambos os lobos parietal e frontal, estão também envolvidos na percepção do fenómeno anormal somatossensorial. Sensações dolorosas, podem estar relacionadas com a incongruência da intenção motora e o feedback e correspondem à ativação das áreas parietal e frontal
- Mecanismos Psicogênicos
A suposição de que a DFa é de origem psicogênica não tem sido suportada pela literatura recente, embora se pense que o stress, ansiedade, cansaço, depressão possam exacerbar a DFa.
Descrever sensibilização central e periférica e relacionar com a hiperalgesia e a alodinea.
Sensibilização periférica é o evento inicial que acompanha o processo inflamatório e implica uma mudança do limiar de ativação das fibras nociceptivas presentes no local da lesão. Normalmente, em um tecido saudável, as terminações nervosas livres, presentes nas fibras nociceptivas, apresentam limiar elevado de ativação, ou seja, somente estímulos lesivos ou com potencial para isso são capazes de ativá-las. Existem transdutores que transformam os estímulos mecânicos, térmicos e químicos em potenciais receptores, que devem ter intensidade suficiente para atingir o limiar de excitação da fibra e deflagrar um potencial de ação. Quando surge o fenômeno da sensibilização periférica, o limiar de excitação das fibras nociceptivas encontra-se alterado e os estímulos que normalmente não ativariam essas fibras conseguem ativá-las.
A lesão tecidual que ocorre após uma agressão causa a liberação de várias substâncias (íons, prostaglandinas, cininas, serotonina, sub P, histamina, etc.) caracterizando uma resposta inflamatória capaz de ativar os nociceptores periféricos. A lesão induz a síntese e a liberação de mediadores inflamatórios. Essas substâncias promovem a sinalização entre as células do tecido lesado e o recrutamento de células distantes. Diante da liberação de mediadores, com o citocinas (TNF, IL -1, IL -6, IL -8), leucotrienos e mediadores plasmáticos com o a bradicinina, as fibras nociceptivas entram no alvo da sinalização intercelular. A presença de receptores para esses mediadores nas fibras nociceptivas permite sua ativação não só por estímulos mecânicos e térmicos, mas também por substâncias químicas geradas pelo processo inflamatório.
A produção de prostaglandinas pela ativação da COX exerce papel fundamental na sensibilização periférica. A ativação do receptor prostanoide presente nas fibras nociceptivas promove mudança bioquímica, aumenta a concentração intracelular de AMPc e a ativação de proteínas quinase, promove a fosforilação dos canais de sódio dependentes de voltagem e diminui o limiar de excitação dessas fibras.
Desse modo, as fibras nociceptivas, com seu limiar de ativação mais baixo provocado pela presença das prostaglandinas, tornam-se mais sensíveis aos outros mediadores inflamatórios. Nesse processo, também ocorre aumento da sensibilidade aos estímulos mecânicos e térmicos que não ativam essas fibras quando elas estão em seu estado normal. Assim, a sensibilização periférica possibilita a ativação de nociceptores por estímulos de baixa intensidade e aumenta a intensidade e a duração da ativação das fibras nociceptivas. Além disso, essa sensibilização periférica caracteriza o estado de hiperalgesia. A continuidade da sensibilização periférica causa o fenômeno da sensibilização central.
Uma vez ocorrido, esse processo causa alterações nas fibras nervosas e gera a sensibilização periférica, que cursa com o aparecimento de resposta exagerada aos estímulos dolorosos (hiperalgesia), aumento da atividade espontânea neuronal, diminuição do limiar necessário para ativação dos nociceptores e aumento da resposta aos estímulos.
A agressão é transmitida para o SNC por meio de fibras do tipo A-delta e C, que se dirigem para o corno dorsal da medula espinal. Com a estimulação persistente dos nociceptores, observa-se uma redução do limiar de sensibilidade fazendo com que os estímulos normalmente não dolorosos resultem em dor (alodinea), além do aparecimento de dor espontânea, manutenção da hiperalgesia primária e secundária, que podem persistir, mesmo após a resolução da lesão tecidual.
Isso sugere que a sensibilização periférica não é responsável por todas essas mudanças e que há um importante envolvimento do SNC nesse processo, o que é chamado de sensibilização central. Esse fenômeno envolve mudanças estruturais e funcionais, chamadas de plasticidade, com adaptações positivas ou negativas.
Para que ocorram mudanças no corno dorsal da medula, é necessário que a ativação de aferentes primários liberem neuropeptídios e aminoácidos excitatórios (sub P, glutamato). Os potenciais pós-sinápticos excitatórios rápidos são mediados pela ação do glutamato via receptores AMPA (ácido alfa-amino-3-hidroxi-5-metil-4-isoxasol propiônico), ligados a canal de sódio e receptores metabotrópico, ligados a proteína G da membrana, que são conhecidos como receptores não-NMDA. Os potenciais pós-sinápticos excitatórios lentos podem ocorres via receptores AMPA, porém seu melhor mecanismo é através dos receptores NMDA (N-metil-D-aspartato) e das taquicininas (sub P e neurocinina A).
A duração prolongada dos potenciais lentos permite que eles sejam somados temporalmente, produzindo um aumento cumulativo na despolarização pós-sináptica. Esse aumento na descarga do potencial de ação às estimulações repetidas é chamado de Wind up. Para que ele ocorra, é necessário que haja ativação dos receptores NMDA.
Semelhantemente à sensibilização periférica dos nociceptores, a transmissão dos neurônios nociceptivos no nível do corno dorsal medular e no núcleo trigeminal pode ser sensibilizada. A sensibilização periférica e central é a principal causa do fenômeno de hipersensibilidade à dor. A sensibilização central amplifica e facilita a transferência sináptica do estímulo nociceptivo oriundo do terminal nociceptor central em direção ao neurônio nociceptivo medular. N a fase inicial (fase aguda), a sensibilização é gerada pelo input nociceptivo transmitido pelo nociceptor central em direção ao neurônio medular – o grau de sensibilização é do tipo atividade-dependente. Na fase tardia da transmissão nociceptiva medular, inicia-se o processo de transcrição genética celular – o grau de sensibilização torna-se transcricional dependente.
Geralmente, a sensibilização central é semelhante à produzida na periferia. As quinases intracelulares são ativadas, resultando na fosforilação dos canais iônicos e receptores, além da alteração genética que induz a alterações de caráter químico e fenotípico no neurônio medular e na sua sinapse.
Devido ao fato citado, as sensibilizações periférica e central são a expressão do fenômeno de plasticidade (cronicidade da dor) do sistema nervoso, fato que modifica funções neuronais envolvidas no processamento do sinal doloroso em nível medular. A submissão da sinapse nociceptiva medular a descargas intensas e prolongadas de estímulos nociceptivos torna os neurônios hiperresponsivos. Após esse tipo de reação, o input não-nociceptivo (toque leve na pele) pode evocar respostas nociceptivas. Simultaneamente, áreas vizinhas às lesões periféricas tornam -se sensíveis ao toque (hiperalgesia secundária).
A sensibilização central requer estimulação nociceptiva rápida ou prolongada, porém intensa, para ser iniciada; por exemplo, uma incisão cirúrgica, isto é, estímulo inflamatório ou neuropático intenso. Esse tipo de sensibilização dá início a um a cascata de eventos no corno dorsal da medula, a qual é gerada pela liberação de uma série de neurotransmissores nos terminais dos nociceptores centrais, que origina alterações na densidade de receptores sinápticos, no seu limiar, na sua cinética e ativação, aumentando o tráfego de sinais nociceptivos na transmissão medular. Um ponto-chave nas alterações fisiopatológicas dos nociceptores medulares envolve as que ocorrem nos receptores NMDA, os quais são glutamato-ativados. Durante o processo de sensibilização, esse receptor é fosforilado, resultando na sua migração dos estoques intracelulares para a membrana sináptica, com o também na elevação da sua responsividade ao glutamato.
Esse aumento de responsividade ao glutamato ocorre pela remoção do bloqueio voltagem-dependente que o magnésio exerce sobre o com plexo receptor/canal iônico NMDA, elevando o tempo de permanência do canal no estado aberto. Esse processo resulta na elevação da responsividade celular aos estímulos infralimiares, com o também em um aumento na resposta aos estímulos nociceptivos de limiar alto. O recrutamento de estímulos infralimiares é manifestado clinicamente por uma redução no limiar de excitabilidade para a geração de dor (alodinia), por uma exagerada resposta ao estímulo nociceptivo (hiperalgesia) ou pela extensão da sensibilidade álgica para os tecidos vizinhos à lesão primária (hiperalgesia secundária).
Explicar os mecanismos de neuromodulação (central e periférica) da dor.
Teoria do portão
A estimulação elétrica do encéfalo produz analgesia Muitos locais de regulação endógena da dor são localizados no encéfalo. Um meio efetivo de suprimir a nocicepção envolve a estimulação da região cinzenta periaquedutal, a área do mesencéfalo que circunda o terceiro ventrículo e o aqueduto cerebral. A estimulação dessa região em animais experimentais provoca uma analgesia profunda e seletiva. Essa analgesia produzida pela estimulação é bastante específica; os animais ainda respondem ao toque, à pressão e à temperatura na área do corpo que exibe analgesia, mas eles sentem menos dor. De fato, a analgesia induzida pela estimulação tem provado ser uma via efetiva para o alívio da dor em um número limitado de condições dolorosas em seres humanos. A estimulação da substância cinzenta periaquedutal é capaz de bloquear os reflexos de retirada mediados de modo espinal que normalmente são evocados pela esti- mulação nociva. Poucos neurônios nessa substância se projetam diretamente para o corno dorsal da medula espinal. Muitos fazem conexões excitatórias com neurônios do bulbo rostroventral, incluindo neurônios serotonérgicos em uma região da linha média chamada de núcleo magno da rafe, ou neurônios dos núcleos do complexo da rafe.
Os axônios desses neurônios serotonérgicos projetam-se através da região dorsal do funículo lateral para a medula espinal, onde eles formam conexões inibitórias com os neurônios das lâminas I, II e V do corno dorsal. Assim, a estimulação do bulbo rostroventral inibe o disparo de muitas classes de neurônios do corno dorsal, incluindo os neurônios de projeção do trato espinotalâmico que transmitem sinais nociceptivos aferentes. Um segundo importante sistema descendente monoaminérgico também pode suprimir a atividade dos neurônios nociceptivos no corno dorsal. Esse sistema noradrenérgico se origina no locus ceruleus e em outros núcleos do bulbo e da ponte. Essas projeções inibem os neurônios das lâminas I e V do corno dorsal por meio de ações sinápticas diretas e indiretas.
Analgesia Endógena
Peptídeos opioides contribuem para o controle endógeno da dor. Desde sua descoberta pelos sumérios em 3300 a.C., a papoula do ópio e seus ingredientes ativos, opiáceos como a morfina e a codeína, têm sido reconhecidos como poderosos agentes analgésicos. Ao longo das últimas duas décadas, tem-se começado a entender muito dos mecanismos moleculares e dos circuitos neurais pelos quais os opiáceos exercem seus efeitos analgésicos.
Além disso, tem-se percebido que as redes neurais envolvidas na analgesia produzida pela estimulação e na induzida pelos opiáceos são intimamente relacionadas. Duas descobertas essenciais levaram a esses avanços. A primeira foi o reconhecimento de que a morfina e outros opiáceos interagem com receptores específicos nos neurônios da medula espinal e do encéfalo. A segunda foi o isolamento de neuropeptídeos endógenos com atividades nesses receptores como as dos opiáceos. A observação de que a naloxona, um antagonista opiáceo, bloqueia a analgesia produzida pela estimulação forneceu a primeira pista de que o encéfalo contém opioides endógenos.
Peptídeos opioides endógenos e seus receptores estão distribuídos nos sistemas moduladores da dor. Os receptores opioides são classificados em quatro classes principais: mu (m), delta (d), kappa (k) e orfanina FQ. Os genes que codificam cada um desses receptores constituem uma subfamília de receptores acoplados a proteínas G. Os receptores m são particularmente diversificados; numerosas isoformas têm sido identificadas, muitas com diferentes padrões de expressão. Esse achado tem impulsionado a procura por fármacos analgésicos que visam isoformas específicas. Os receptores opioides foram originalmente definidos com base em sua afinidade de ligação a diferentes compostos agonistas. A morfina e outros alcaloides opioides são agonistas potentes para receptores m, e há uma forte correlação entre a potência de um analgésico e sua afinidade de ligação a esses receptores. Camundongos nos quais o gene para o receptor m foi inativado são insensíveis à morfina e a outros agonistas opioides. Muitos fármacos antagonistas opioides, como a naloxona, também se ligam ao receptor m e competem com a morfina para ocupá-lo sem ativar a sinalização do receptor. Os receptores m são altamente concentrados na superfície do corno dorsal da medula espinal, no bulbo ventral e na substância cinzenta periaquedutal, locais anatômicos importantes para a regulação da dor. Contudo, como em outras classes de receptores opioides, eles também são encontrados em muitos outros lugares nos sistemas nervosos central e periférico. Sua ampla distribuição explica por que a administração sistêmica de morfina influencia muitos processos fisiológicos além da percepção da dor.
A descoberta dos receptores opioides e de sua expressão pelos neurônios dos sistemas nervosos central e periférico levou à definição de quatro importantes classes de peptídeos opioides endógenos, cada uma interagindo com uma classe específica de receptores opioides. Três classes − as encefalinas, as b-endorfinas e as dinorfinas − são as mais bem caracterizadas. Esses peptídeos são formados a partir de grandes precursores polipeptídicos por clivagem enzimática e codificados por genes diferentes. Apesar das diferenças na sequência de aminoácidos, cada um contém a sequência Tyr-Gly-Gly-Phe. Há duas encefalinas, a leucil-encefalina e a metionil-encefalina, que são pequenos peptídeos intimamente relacionados. A b-endorfina é um produto da clivagem de um precursor que também gera o peptídeo ativo do hormônio adrenocorticotrófico (ACTH, de A descoberta dos receptores opioides e de sua expressão pelos neurônios dos sistemas nervosos central e periférico levou à definição de quatro importantes classes de peptídeos opioides endógenos, cada uma interagindo com uma classe específica de receptores opioides. Três classes − as encefalinas, as b-endorfinas e as dinorfinas − são as mais bem caracterizadas. Esses peptídeos são formados a partir de grandes precursores polipeptídicos por clivagem enzimática e codificados por genes diferentes. Apesar das diferenças na sequência de aminoácidos, cada um contém a sequência Tyr-Gly-Gly-Phe. Há duas encefalinas, a leucil-encefalina e a metionil-encefalina, que são pequenos peptídeos intimamente relacionados. A b-endorfina é um produto da clivagem de um precursor que também gera o peptídeo ativo do hormônio adrenocorticotrófico (ACTH, de adrenocorticotropic hormone). A b-endorfina e o ACTH são sintetizados por células na hipófise e são liberados na circulação sanguínea em resposta ao estresse. As dinorfinas são derivadas do produto proteico do gene da dinorfina. As encefalinas agem nos receptores m e d, enquanto a dinorfina é um agonista relativamente seletivo do receptor k. O quarto peptídeo opioide endógeno é a orfanina FQ ou nociceptina (OFQ/N1-17). Esse peptídeo de 17 aminoácidos está relacionado em sequência à dinorfina e se liga ao receptor OFQ/N. Os membros das quatro classes de peptídeos opioides são amplamente distribuídos no sistema nervoso central, e os peptídeos individuais estão localizados em locais associados com o processamento ou a modulação da informação nociceptiva. Corpos das células neuronais e terminais axonais contendo encefalina e dinorfina são encontrados no corno dorsal da medula espinal, em particular nas lâminas I e II, bem como no bulbo ventral rostral e na substância cinzenta periaquedutal. Neurônios que sintetizam b-endorfina são primariamente confinados ao hipotálamo; seus axônios terminam na substância cinzenta periaquedutal e/ou nos neurônios noradrenérgicos do tronco encefálico. A orfanina FQ parece participar de uma ampla variedade de outras funções fisiológicas.
Descrever a ação dos anticonvulsivantes e sua fundamentação farmacológica no tratamento da dor crônica.
Os agentes anticonvulsivantes estão entre os fármacos mais bem estudados para a dor neuropática e há bastante evidencias em favor da sua eficácia. Muito deles agem bloqueando os canais de sódio e de cálcio e diminuem a excitabilidade neuronial. Essa classe de medicamentos é usada desde 1960 e se constituem em uma das classes mais importantes no tratamento da dor.
A utilização dos anticonvulsivantes na dor neuropática é justificada pelas semelhanças entre os mecanismos fisiopatológicos desta condição e da epilepsia, devido especialmente à hiperexcitabilidade neuronal presente em ambas.
Esses fármacos são estabilizadores de membrana e atuam através de canais de sódio e cálcio voltagem-dependente, aumentando os efeitos inibitórios do ácido γ-aminobutírico (GABA) e diminuindo a transmissão excitatória do glutamato.
- Mecanismo de ação:
Os gabapentinóides agem como neuromoduladores através da ligação seletiva à subunidade protéica α2δ dos canais de cálcio voltagemdependente em várias áreas do cérebro e no corno dorsal da medula espinhal. As subunidades α2δ localizadas no prosencéfalo e tronco cerebral desempenham um papel no processamento da dor e na via inibitória descendente da dor e são estimuladas no corno dorsal da medula espinhal em condições de inflamação e dor neuropática, aumentando a excitabilidade neuronal através do influxo intensificado de cálcio.
A ligação dos gabapentinóides à esta subunidade leva à diminuição do influxo de cálcio nos neurônios e, consequentemente, à inibição da liberação de neurotransmissores excitatórios importantes na produção da dor. Efeitos sobre os canais de sódio e potássio também foram demonstrados, mas não se comparam ao seu mecanismo de ação principal.
- Vantagens:
O maior número de evidências científicas no tratamento da dor neuropática e um menor número de efeitos colaterais associados à farmacoterapia em comparação aos demais anticonvulsivantes torna o uso dos gabapentinóides mais adequado nesta condição.
- Desvantagens:
A principal desvantagem no uso dos gabapentinóides se deve ao custo do seu tratamento, pois mesmo a gabapentina apresentando formulação genérica, ainda assim a farmacoterapia é dispendiosa em comparação aos demais anticonvulsivantes e aos ADTs, como a amitriptilina.
Os efeitos colaterais representam uma de suas desvantagens e são caracterizados por sonolência, vertigem, distúrbios gastrointestinais e edema periférico. Pacientes com insuficiência renal devem ter cuidados adicionais, e o uso de doses menores pode ser necessário.
- Gabapentina:
É amplamente utilizada no tratamento da dor neuropática. Foi estudada em diversos ensaios clínicos, e através destes foi documentado um efeito moderado no alívio da dor e na qualidade de vida (incluindo humor e distúrbios do sono) em estados de dor neuropática mista, neuralgia pós-herpética, neuropatia diabética dolorosa, lesão na medula espinhal e dor por membro fantasma.
Embora tenha uma estrutura semelhante ao GABA, a gabapentina não tem afinidade por receptores GABA, e seu mecanismo de ação parece alheio a qualquer efeito sobre o sistema gabaérgico.
- Mecanismo de ação:
A gabapentina liga-se a uma proteína nas membranas corticais com uma sequência de aminoácidos idêntica à subunidade α2δ de canal de cálcio do tipo L sensível à voltagem. Desse modo, a gabapentina reduz a liberação sináptica de neurotransmissores e diminui o influxo pós-sináptico de Ca²+, resultando na diminuição da excitação.
REFERENCIAS BIBLIOGRÁFICAS
- Revista Brasileira de Farmácia. MEDAWAR, Camile Valle ; MATHEUS, Maria Eline. Antidepressivos Tricíclicos e Gabapentinóides: uma análise do perfil farmacológico no tratamento da dor neuropática. 2012. Acesso em: <http://www.rbfarma.org.br/files/rbf-2012-93-3-4.pdf> .
- Universidade Federal de Alagoas, Eliane Aparecida Campesatto; Camila Emily Batista Sales Marques. Uso de gabapentina no tratamento da dor neuropática e do topiramato na enxaqueca. <https://www.uninter.com/revistasaude/index.php/saudeDesenvolvimento/article/viewFile/66/29>
- Universidade do Porto. Dor no amputado. 2012.
- Revista de Neurociências. Revisão Sistemática sobre tratamento Medicamentoso para Dor no Membro Fantasma. http://www.revistaneurociencias.com.br/edicoes/2014/2202/original/894original.pdf
- Chamlian TR, Bonilha MMM, Macêdo MCM, Rezende F, Leal CAP Prevalência de dor fantasma em amputados do Lar Escola São Francisco.
- Sociedade de Anestesiologia do Estado do Rio de Janeiro. Livro – Dor. 2003.
- NETO ALVES, Onofre; JACOBSEN, Manoel Teixeira; DE SIQUEIRA, José Tadeu; COSTA, Carlos Maurício de Castro. Dor: Princípios e Prática. Editora Artmed AS, 2009.
- KANDEL, Eric R. et al. Princípios de Neurociências. 5. ed. Porto Alegre: Amgh Editora Ltda, 2014.
- Faculdade de Medicina Ribeirão Preto – USP. Sensibilização Central. https://edisciplinas.usp.br/pluginfile.php/310319/mod_resource/content/1/Sensibilizac%CC%A7a%CC%83o%20central%20-%20graduac%CC%A7a%CC%83o.pdf
- Departamento de Fisiologia, Unesp – Botucatu. Mecanismos de comunicação entre os neurônios e dos neurônios com os órgãos efetuadores. http://www.ibb.unesp.br/Home/Departamentos/Fisiologia/Neuro/04.sinapse.pdf
- Revista Brasileira de Anestesiologia. Dor: aspectos atuais da sensibilização periférica e central. http://www.scielo.br/pdf/rba/v57n1/11.pdf






Comentários